Алена Титаренко - Шпаргалка по органической химии
- Название:Шпаргалка по органической химии
- Автор:
- Жанр:
- Издательство:Литагент «Ай Пи Эр Медиа»db29584e-e655-102b-ad6d-529b169bc60e
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Алена Титаренко - Шпаргалка по органической химии краткое содержание
Настоящее пособие представляет собой краткое изложение ответов на экзаменационные вопросы. Структура пособия соответствует общегосударственному образовательному стандарту по дисциплине «Органическая химия». Настоящее издание поможет систематизировать полученные ранее знания, а также подготовиться к экзамену или зачету по данному предмету и успешно сдать их.
Пособие предназначено для студентов высших, среднеспециальных и средних образовательных учреждений.
Шпаргалка по органической химии - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
б) водород присоединяется по месту двойных связей в углеводородных радикалах, и масло превращается в твердый жир, например:
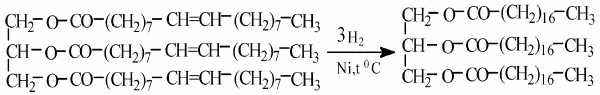
4. В промышленности процесс гидрирования осуществляется в ряде последовательно соединенных автоклавов по непрерывному методу.
Проходя через систему автоклавов, жир подвергается все большему гидрированию; в результате получается масса, похожая по своей консистенции на сало.
Гидрированное масло называется еще саломасом. От катализатора саломас отделяется при помощи фильтрования.
Гидрированный жир– полноценный продукт для производства мыла, а при использовании определенных сортов масел – и для употребления в пищу, например в составе маргарина.
58. Мыла и другие моющие средства
Характерные особенности мыла:
1) мыла– это соли высших карбоновых кислот;
2) обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот;
3) натриевые соли образуют твердые мыла, калиевые соли – жидкие мыла;
4) мыла получаются при гидролизе жиров в присутствии щелочей:
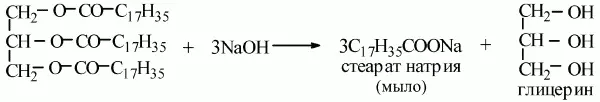
5) происходит реакция омыления;
6) омыление жиров может протекать и в присутствии серной кислоты (кислотное омыление);
7) при кислотном омылении получаются глицерин и высшие карбоновые кислоты;
8) карбоновые кислоты действием щелочи или соды переходят в мыла;
9) исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода;
10) растительные масла предварительно подвергаются гидрогенизации.
Гидрогенизация– это превращение растительного масла в твердые жиры.
Заменители жиров– это синтетические карбоновые жирные кислоты с большой молекулярной массой.
Получение мыла из непищевых продуктов:
1) необходимые для производства мыла карбоновые кислоты получаются окислением парафина;
2) нейтрализацией кислот, которые содержат от 10 до16 углеродных атомов в молекуле, получается туалетное мыло;
3) нейтрализацией кислот, которые содержат от 17 до 21 атома углерода, получается хозяйственное мыло и мыло для технических целей;
4) наряду с мылом из синтетических кислот производятся моющие средства из других видов сырья.
Алкилсульфаты– это соли сложных эфиров высших спиртов и серной кислоты.
В общем виде образование таких солей можно записать уравнениями:
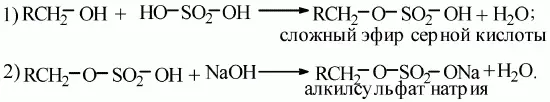
Особенности образующихся солей.
1. Эти соли содержат в молекуле от 12 до 14 углеродных атомов.
2. Они обладают очень хорошими моющими свойствами.
3. Кальциевые и магниевые соли растворимы в воде.
4. Такие мыла моют в жесткой воде.
5. Алкилсульфаты содержатся во многих стиральных порошках.
6. Синтетические моющие средства высвобождают сотни тысяч тонн пищевого сырья – растительных масел и жиров.
59. Глюкоза. Физические свойства
Глюкоза – бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус (лат. «глюкос» – сладкий):
1) она встречается почти во всех органах растения: в плодах, корнях, листьях, цветах;
2) особенно много глюкозы в соке винограда и спелых фруктах, ягодах;
3) глюкоза есть в животных организмах;
4) в крови человека ее содержится примерно 0,1 %.
Особенности строения глюкозы
1. Состав глюкозы выражается формулой: С 6Н 12O 6, она принадлежит к многоатомным спиртам.
2. Если раствор этого вещества прилить к свежеосажденному гидроксиду меди (II), образуется ярко-синий раствор, как в случае глицерина.
Опыт подтверждает принадлежность глюкозы к многоатомным спиртам.
3. Существует сложный эфир глюкозы, в молекуле которого пять остатков уксусной кислоты. Из этого следует, что в молекуле углевода пять гидроксильных групп. Этот факт объясняет, почему глюкоза хорошо растворяется в воде и имеет сладкий вкус.
Если раствор глюкозы нагреть с аммиачным раствором оксида серебра (I), то получится характерное «серебряное зеркало».
Шестой атом кислорода в молекуле вещества входит в состав альдегидной группы.
4. Чтобы составить полное представление о строении глюкозы, надо знать, как построен скелет молекулы. Поскольку все шесть атомов кислорода входят в состав функциональных групп, следовательно, атомы углерода, образующие скелет, соединены друг с другом непосредственно.
5. Цепь атомов углерода прямая, а не разветвленная.
6. Альдегидная группа может находиться только в конце неразветвленной углеродной цепи, и гидроксильные группы могут быть устойчивы, находясь лишь у разных атомов углерода.
7. Глюкоза одновременно и альдегид, и многоатомный спирт: она альдегидоспирт.
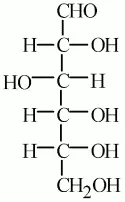
8. В растворе глюкозы содержатся молекулы не только с открытой цепью атомов, но и циклические, в которых нет альдегидной группы.
9. Процесс превращения альдегидной формы в циклическую обратим. В растворе существует подвижное равновесие между ними. Данное явление называется мутаротацией.
Молекул, которые содержат альдегидную группу, недостаточно, чтобы ярко проявилась реакция глюкозы с фуксинсернистой кислотой.
60. Химические свойства глюкозы и ее применение
Химические свойства альдегидной формы глюкозы:
а) глюкоза – это вещество с двойственной химической природой;
б) как многоатомный спирт глюкоза образует сложные эфиры;
в) как альдегид она окисляется. Окислительное действие аммиачного раствора оксида серебра (I) на глюкозу можно записать следующим образом:
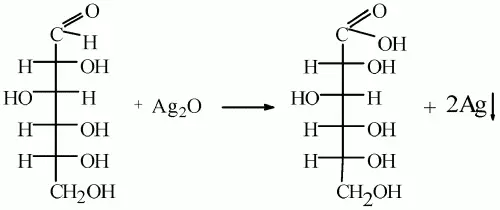
г) окислителем альдегидной группы глюкозы может служить и гидроксид меди (II). Если к небольшому количеству свежеосажденного гидроксида меди (II) прилить раствор глюкозы и смесь нагреть, то образуется красный оксид меди (I). Уравнение реакции окисления глюкозы гидроксидом меди (II) аналогично уравнению для альдегидов;
д) альдегидная группа глюкозы может быть восстановлена.
Тогда образуется шестиатомный спирт (сорбит): СН 2ОН-СНОН-СНОН-СНОН-СНОН-СН 2ОН.
Виды брожения.
1. Спиртовое брожение идет под действием фермента дрожжей: С 6Н 12O 6→ 2С 2Н 5ОН + 2СO 2.
Читать дальшеИнтервал:
Закладка:










