Алена Титаренко - Шпаргалка по органической химии
- Название:Шпаргалка по органической химии
- Автор:
- Жанр:
- Издательство:Литагент «Ай Пи Эр Медиа»db29584e-e655-102b-ad6d-529b169bc60e
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Алена Титаренко - Шпаргалка по органической химии краткое содержание
Настоящее пособие представляет собой краткое изложение ответов на экзаменационные вопросы. Структура пособия соответствует общегосударственному образовательному стандарту по дисциплине «Органическая химия». Настоящее издание поможет систематизировать полученные ранее знания, а также подготовиться к экзамену или зачету по данному предмету и успешно сдать их.
Пособие предназначено для студентов высших, среднеспециальных и средних образовательных учреждений.
Шпаргалка по органической химии - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
В растениях они образуются в результате фотосинтеза: nСO 2+ mН 2О → Сn (Н 2О) m + n O 2;
5) содержание углеводов в растениях составляет до 80 % массы сухого вещества, в организмах человека и животных – до 20 %;
6) они играют важную роль в физиологических процессах.
Олигосахариды– это продукты конденсации двух или нескольких молекул моносахаридов.
Дисахариды (диозы)– это продукты конденсации двух молекул моносахаридов.
50. Кетоны
Кетонаминазываются карбонилсодержащие соединения, в которых углерод карбонильной группы связан с двумя углеродными радикалами.
Общая формула кетонов —
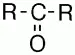
В соответствии с международной номенклатурой названия кетонов строятся из названия соответствующего углеводорода с добавлением окончания – он. В конце названия ставится цифра, указывающая положение в цепи атома углерода, с которым связан карбонильный кислород. Если разветвленность одинакова, то нумеруют с того конца цепи, к которому ближе расположена карбонильная группа.

Для некоторых кетонов распространены тривиальные названия, например ацетон.
Физические свойства.Простейшие кетоны являются бесцветными жидкостями, которые растворяются в воде. Кетоны обладают приятным запахом. Высшие кетоны – твердые вещества. Газообразных кетонов не бывает, так как уже простейший из них (ацетон) – жидкость. Многие химические свойства, характерные для альдегидов, проявляюся и у кетонов.
Химические свойства:
1) для кетонов характерны те же реакции замещения по α-С атому:
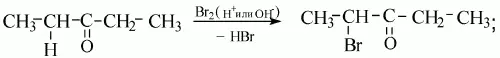
2) гидрирование кетонов в присутствии катализаторов приводит к образованию вторичных спиртов.
Кетоныокисляются значительно труднее альдегидов и только сильными окислителями. При окислении кетонов происходит разрыв (деструкция) углеродной цепи, и образуется смесь продуктов. Кетоны не вступают в реакцию «серебряного зеркала».
Получение:
1) кетоны образуются при окислении или каталитическом дегидрировании вторичных спиртов в присутствии медных катализаторов, например:
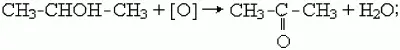
2) как и альдегиды, кетоны можно получить гидролизом дигалогенпроизводных алканов. Чтобы получился кетон, оба атома галогена в исходном соединении должны находиться при одном (не крайнем) атоме углерода:
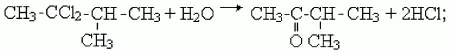
3) кетоны образуются в результате присоединения воды к гомологам ацетилена в присутствии катализаторов – солей ртути (II), например:
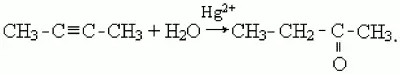
51. Одноосновные карбоновые кислоты
Строение и физические свойства кислот.
Карбоновые кислоты– это органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, которые соединены с углеводородным радикалом. В зависимости от числа карбоксильных групп в молекуле различают кислоты одноосновные и двуосновные.
Гомологический ряд одноосновных карбоновых кислот:
1) муравьиная кислота Н-СООН;
2) уксусная кислота СН 3-СООН;
3) пропионовая кислота СН 3-СН 2-СООН;
4) масляная кислота СН 3-СН 2-СН 2-СООН;
5) валериановая кислота СН 3-(СН 2) 3-СООН;
6) капроновая кислота СН 3-(СН 2) 4-СООН.
Твердые вещества:
1) пальмитиновая кислота СН 3-(СН 2) 14-СООН;
2) маргариновая кислота СН 3-(СН 2) 15-СООН;
3) стеариновая кислота СН 3-(СН 2) 16-СООН.
Существуют также бензойная, щавелевая, терефталевая, молочная кислоты.
По систематической номенклатуре названия кислот образуются от названий соответствующих углеводородов с прибавлением слова кислота, например: метановая кислота HCOOH, пропановая кислота СН 3-СН 2-СOOH.
Характерные особенности карбоновых кислот:
1) среди кислот, в отличие от альдегидов, нет газообразных веществ, так как молекулы ассоциированы;
2) низшие представители ряда – это жидкости с острым запахом, хорошо растворимые в воде;
3) с повышением молекулярной массы растворимость в воде понижается;
4) высшие кислоты – твердые вещества без запаха, в воде не растворимы;
5) определение молекулярной массы жидких кислот показывает, что они состоят из удвоенных молекул – димеров;
6) между двумя молекулами могут устанавливаться две водородные связи, это и обусловливает сравнительно большую прочность димерных молекул.
7) ароматическими карбоновыми кислотами называют производные бензола и его гомологов, содержащие карбоксильные группы, непосредственно связанные с углеродными атомами ароматического ядра, например C 6H 5-COOH – бензойная, если же карбоксильная группа находится в боковой цепи, то такие кислоты называют жирноароматическими, они напоминают в своем химическом поведении карбоновые кислоты алифатического ряда. Например: C 6H 5-CH 2-COOH – фенилуксусная;
8) по количеству карбоксильных групп ароматические кислоты могут быть одно-, двух– и более основные;
9) под влиянием карбонильного атома кислорода изменяются свойства водородного атома в гидроксильной группе;
10) электронная плотность связи С=О (особенно π-связи) смещена в сторону кислорода, как элемента более электроотрицательного.
52. Химические свойства и получение карбоновых кислот
Химические свойства:
1) растворимые в воде кислоты, в отличие от спиртов, имеют характерный кислый вкус;
2) кислоты окрашивают лакмус в красный цвет;
3) карбоновые кислоты проводят электрический ток;
4) их диссоциацию в водном растворе можно выразить уравнением: R-COOH – >H ++ R-СОО -;
5) по степени диссоциации только муравьиная кислота является электролитом средней силы;
6) остальные карбоновые кислоты относятся к слабым электролитам;
7) по мере повышения молекулярной массы степень диссоциации карбоновых кислот понижается;
8) при действии на растворы кислот некоторых металлов происходит выделение водорода и образование соли (ацетат магния), например:
2СН 3-COOH + Mg → Н 2+ (CH 3COO) 2Mg.
Ионное уравнение этой реакции:
2СН 3СООН + Mg → Н 2+ Mg 2++ 2СН 3СОО -;
9) выделение водорода идет медленнее, чем при реакции металла с сильными кислотами – серной и соляной;
Читать дальшеИнтервал:
Закладка:










