Ольга Макарова - Шпаргалка по неорганической химии
- Название:Шпаргалка по неорганической химии
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ольга Макарова - Шпаргалка по неорганической химии краткое содержание
Настоящее пособие представляет собой краткое изложение ответов на экзаменационные вопросы. Структура пособия соответствует общегосударственному образовательному стандарту по дисциплине «Неорганическая химия». Настоящее издание поможет систематизировать полученные ранее знания, а также подготовиться к экзамену или зачету по данному предмету и успешно сдать их.
Пособие предназначено для студентов высших, среднеспециальных и средних образовательных учреждений.
Шпаргалка по неорганической химии - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
41. Кремний и его свойства
Кремний (Si) –стоит в 3 периоде, IV группе главной подгруппы периодической системы. Физические свойства:кремний существует в двух модификациях: аморфной и кристаллической. Аморфный кремний – порошок бурого цвета, плотностью 2,33 г/см3, растворяется в расплавах металлов. Кристаллический кремний – это кристаллы темно-серого цвета, обладающие стальным блеском, твердый и хрупкий, плотностью 2,4 г/см3. Кремний состоит из трех изотопов: Si (28), Si (29), Si (30).
Химические свойства:электронная конфигурация: 1s22s22p6 3 s2 3p2 .Кремний – неметалл. На внешнем энергетическом уровне кремний имеет 4 электрона, что обуславливает его степени окисления: +4, -4, -2. Валентность – 2, 4. Аморфный кремний обладает большей реакционной способностью, чем кристаллический. При обычных условиях он взаимодействует со фтором: Si + 2F2 = SiF4. При 1000 °C Si реагирует с неметаллами: с CL2, N2, C, S.
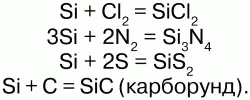
Из кислот кремний взаимодействует только со смесью азотной и плавиковой кислот:
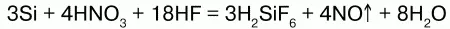
По отношению к металлам ведет себя по-разному: в расплавленных Zn, Al, Sn, Pb он хорошо растворяется, но не реагирует с ними; с другими расплавами металлов – с Mg, Cu, Fe кремний взаимодействует с образованием силицидов: Si + 2Mg = Mg2Si. Кремний горит в кислороде: Si + O2 = SiO2 (песок).
Диоксид кремния или кремнезем– стойкое соединение Si, широко распространен в природе. Реагирует со сплавлением его с щелочами, основными оксидами, образуя соли кремниевой кислоты – силикаты. Получение:в промышленности кремний в чистом виде получают восстановлением диоксида кремния коксом в электропечах: SiO2 + 2С = Si + 2СO?.
В лаборатории кремний получают прокаливанием с магнием или алюминием белого песка:
SiO2 + 2Mg = 2MgO + Si.
3SiO2 + 4Al = Al2О3 + 3Si.
Кремний образует кислоты: Н2 SiO3 – мета-кремниевая кислота; Н2 Si2O5 – двуметакремниевая кислота.
Нахождение в природе:минерал кварц – SiO2. Кристаллы кварца имеют форму шестигранной призмы, бесцветные и прозрачные, называются горным хрусталем. Аметист – горный хрусталь, окрашенный примесями в лиловый цвет; дымчатый топаз окрашен в буроватый цвет; агат и яшма – кристаллические разновидности кварца. Аморфный кремнезем менее распространен и существует в виде минерала опала – SiO2 nН2О. Диатомит, трепел или кизельгур (инфузорная земля) – землистые формы аморфного кремния.
42. Понятие коллоидных растворов
Коллоидные растворы– высокодисперсные двухфазные системы, состоящие из дисперсионной среды и дисперсной фазы. По размерам частиц являются промежуточными между истинными растворами, суспензиями и эмульсиями. У коллоидных частицмолекулярный или ионный состав.
Существуют три типа внутренней структуры первичных частиц.
1. Суспензоиды (или необратимые коллоиды)– гетерогенные системы, свойства которых можно определить развитой межфазовой поверхностью. По сравнению с суспензиями более высокодисперсные. Не могут долго существовать без стабилизатора дисперсности. Их называют необратимыми коллоидамииз-за того, что их осадки после выпаривания вновь не образуют золей. Их концентрация мала – 0,1 %. От вязкости дисперсной среды отличаются незначительно.
Суспензоиды можно получить:
1) методами диспергирования (измельчение крупных тел);
2) методами конденсации (получение нерастворимых соединений при помощи реакций обмена, гидролиза и т. п.).
Самопроизвольное уменьшение дисперсности у суспензоидов зависит от свободной поверхностной энергии. Чтобы получить длительно сохраняющуюся суспензию, необходимы условия для ее стабилизации.
Устойчивые дисперсные системы:
1) дисперсионная среда;
2) дисперсная фаза;
3) стабилизатор дисперсной системы.
Стабилизатор может быть ионный, молекулярный, но чаще всего – высокомолекулярный.
Защитные коллоиды– высокомолекулярные соединения, которые добавляют для стабилизации (белки, пептиды, поливиниловый спирт и др.).
2. Ассоциативные (или мицеллярные коллоиды) –полуколлоиды, возникающие при достаточной концентрации молекул, состоящих из углеводородных радикалов (дифильные молекулы) низкомолекулярных веществ при ассоциации их в агрегаты молекул (мицеллы). Мицеллыобразуются в водных растворах моющих средств (мыл), органических красителей.
3. Молекулярные коллоиды (обратимые или лиофильные коллоиды) –природные и синтетические высокомолекулярные вещества с большим молекулярным весом. Молекулы их имеют размер коллоидных частиц (макромолекулы).
Разбавленные растворы коллоидов высокомолекулярных соединений – гомогенные растворы. При сильном разбавлении эти растворы подчиняются законам разбавленных растворов.
Неполярные макромолекулы растворяются в углеводородах, полярные – в полярных растворителях.
Обратимые коллоиды– вещества, сухой остаток которых при добавлении новой порции растворителя вновь переходит в раствор.
43. Соли кремниевой кислоты
Общая формула кремниевых кислот – n SiO2? m H2O.В природе находятся в основном в виде солей, в свободной форме выделены немногие, например, HSiO (ортокремниевая) и H2SiO3 (кремниевая или метакремниевая).
Получение кремниевой кислоты:
1) взаимодействие силикатов щелочных металлов с кислотами: Na2SiO3 + 2HCl = H2SiO3 + 2NaCl;
2) кремневая кислота является термически неустойчивой: H2SiO3 = H2O + SiO2.
H2SiO3 образует пересыщенные растворы, в которых в результате полимеризации образует коллоиды. Используя стабилизаторы, можно получить стойкие коллоиды (золи). Их используют в производстве. Без стабилизаторов из раствора кремниевой кислоты образуется гель, осушив который можно получить силикагель (используют как адсорбент).
Силикаты– соли кремниевой кислоты. Силикаты распространены в природе, земная кора состоит в большинстве из кремнезема и силикатов (полевые шпаты, слюда, глина, тальк и др.). Гранит, базальт и другие горные породы имеют в своем составе силикаты. Изумруд, топаз, аквамарин – кристаллы силикатов. Растворимы только силикаты натрия и калия, остальные – нерастворимы. Силикаты имеют сложный химический состав:
Каолин Al2O3; 2SiO2; 2H2Oили H4Al2SiO9.
Асбест CaO; 3MgO; 4SiO 2или CaMgSi4O12.
Получение:сплавление оксида кремния со щелочами или карбонатами:
Читать дальшеИнтервал:
Закладка:









