Елена Шкарина - Рабочая тетрадь по неорганической химии
- Название:Рабочая тетрадь по неорганической химии
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:9785005142931
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Елена Шкарина - Рабочая тетрадь по неорганической химии краткое содержание
Рабочая тетрадь по неорганической химии - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Рабочая тетрадь по неорганической химии
Елена Владимировна Шкарина
© Елена Владимировна Шкарина, 2022
ISBN 978-5-0051-4293-1
Создано в интеллектуальной издательской системе Ridero
От автора
Здравствуйте!
Меня зовут Елена Владимировна. Я репетитор по химии с 20-тилетним стажем.
Очень важно при подготовке к экзаменам по химии (и не только) четко структурировать материал, знать закономерности и иметь под рукой всю необходимую теорию. При этом не менее значимым для ее усвоения является собственноручное написание уравнений реакции – тут вам и тренировка, и лучшее запоминание. Поэтому к своему курсу подготовки я создала эту рабочую тетрадь. В ней можно и нужно писать!
Заполнять ее вам придется самостоятельно. Материал можно брать из моих лекций и вебинаров, либо из учебников и справочников. Это вам позволит не только выучить химию на 100 баллов, но и научиться работать с учебной литературой. Важное умение, в институте пригодится!
Инструкция
1. Начинайте с первого химического элемента и продвигайтесь далее по порядку.
2. Прежде чем заполнять конспект, ознакомьтесь с теорией.
3. На каждой строке пишите по одному уравнению реакции.
4. В конце каждого конспекта (посвященного, как правило, отдельному элементу) есть место «Для заметок». Оно для того, чтобы вписать дополнительную информацию, которая может появиться в процессе подготовки.
Если вы заметили неточности, опечатки или ошибки, сообщите пожалуйста в WhatsApp по номеру +7 (903) 1787693.
Успехов в подготовке!
Водород
Общая характеристика
1. Положение в ПС___________________________________________________
2. Строение атома (число e -, n 0, p +) ________________________________
3. Электронная конфигурация_____________________________________
4. Внешний электронный уровень_________________________________
5. Валентности_______________________________________________________
6. Степени окисления (в соединениях):
+1
0
– 1
Степень окисления 0. Простое вещество H 2
Физические св-ва ___________________________________________________
Получение
В промышленности
1. Электролиз водных растворов солей
________________________________________________________________________
2. Пропускание водных паров над коксом/цинком/железом/
магнием
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
3. Из природного газа
________________________________________________________________________
4. Крекинг, реформинг углеводородов
________________________________________________________________________
________________________________________________________________________
В лаборатории
1. Действием разбавленных кислот на металлы
________________________________________________________________________
2. Действием щелочей на цинк или алюминий
________________________________________________________________________
3. Действием щелочей на кремний
________________________________________________________________________
4. Гидролиз гидридов
________________________________________________________________________
5. Действием воды на металлы I, II групп
________________________________________________________________________
6. Электролиз растворов солей
________________________________________________________________________
Химические свойства
А. Восстановитель
1. С неметаллами
с хлором _____________________________________________________________
с кислородом ________________________________________________________
с серой _______________________________________________________________
с азотом ___________________________________ (условия:______________)
с углеродом __________________________________________________________
Si + H 2 ≠
P + H 2 ≠
2. С оксидами металлов (кроме металлов I – III групп)
________________________________________________________________________
3. С оксидом углерода (II)
________________________________________________________________________
4. С другими сложными неорганическими веществами
________________________________________________________________________
Б. Окислитель
5. С активными металлами I – III групп
________________________________________________________________________
В. С органическими соединениями
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
Степень окисления -1. Гидриды
Получение
1. С щелочными металлами
________________________________________________________________________
2. AlCl 3+ LiAlH 4= AlH 3+3LiCl
Химические свойства
1. Гидролиз
________________________________________________________________________
2. С оксидами металлов
________________________________________________________________________
2AlH 3+3ZnO = 2Al +3Zn +3H 2O
3. Термическое разложение
________________________________________________________________________
4. 3CaH 2+ N 2= Ca 3N 2 +3H 2
Степень окисления +1. Вода
Химические свойства
При комнатной температуре
1. С металлами I, II группы (кроме Mg, Be)
________________________________________________________________________
2. С основными оксидами (если образуется щелочь)
________________________________________________________________________
3. С галогенами
F 2:_____________________________________________________________________
Cl 2: ___________________________________________________________________
________________________________________________________________________
4. С кислотными оксидами (кроме SiO 2)
________________________________________________________________________
5. C ангидридами и галогенангидридами карбоновых
и неорганических кислот
________________________________________________________________________
________________________________________________________________________
6. С активными металлорганическими соединениями
(RMgBr, CH 3Na и т. д.)
________________________________________________________________________
7. С карбидами, нитридами, фосфидами, силицидами,
гидридами активных металлов (Ca, Na, Li и др.)
________________________________________________________________________
8. C галогенидами неметаллов (P, Si)
________________________________________________________________________
9. С солями (гидролиз)
________________________________________________________________________
При нагревании
10. С металлами (Mg, Mn – Pb)
Mg:___________________________________________________________________
Zn:____________________________________________________________________
Fe:____________________________________________________________________
11. С углем, метаном
С:_____________________________________________________________________
CH 4:___________________________________________________________________
В присутствии катализатора
12. С амидами, эфирами карбоновых кислот (H +)
________________________________________________________________________
13. С ацетиленом и другими алкинами (Hg 2+)
________________________________________________________________________
________________________________________________________________________
14. С алкенами (H +)
________________________________________________________________________
15. С нитрилами (H +)
________________________________________________________________________
ДЛЯ ЗАМЕТОК
Галогены
Общая характеристика
1. Положение в ПС _____________________________________________________
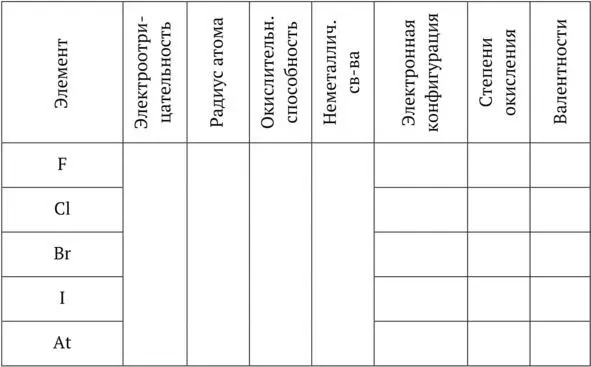
Степень окисления 0. Простые вещества
Получение
В промышленности
1. Электролиз расплавов и растворов солей (единственный
способ получения фтора)
________________________________________________________________________
Читать дальшеИнтервал:
Закладка:










