Ольга Макарова - Шпаргалка по неорганической химии
- Название:Шпаргалка по неорганической химии
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ольга Макарова - Шпаргалка по неорганической химии краткое содержание
Настоящее пособие представляет собой краткое изложение ответов на экзаменационные вопросы. Структура пособия соответствует общегосударственному образовательному стандарту по дисциплине «Неорганическая химия». Настоящее издание поможет систематизировать полученные ранее знания, а также подготовиться к экзамену или зачету по данному предмету и успешно сдать их.
Пособие предназначено для студентов высших, среднеспециальных и средних образовательных учреждений.
Шпаргалка по неорганической химии - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Температуры плавления элементов триады железа высокие, тем не менее, ниже, чем у элементов, находящихся в серединах серий переходных металлов.
Железо– первый элемент в переходных рядах, имеющий спаренный электрон на внутренней d-орбитали. Спаренные электроны с такой орбитали труднее участвуют в образовании химической связи, чем неспаренные. У триады железа существуют особенности орбитального строения, проявляющиеся в виде магнитных и ферромагнитных свойств. В результате ориентированности атомов металлы образуют постоянные магниты. Все металлы семейства железа проявляют электроположительное поведение. Инертны в среде окислителя, даже кислорода, так как образуют оксидные пленки.
Химические свойства железа:
1) взаимодействует с кислородом при высоких температурах;
2) оксиды в низшей степени окисления MO;
3) при взаимодействии с галогенами образует галогениды, дигалогениды;
4) образует комплексные соединения;
5) образует карбонилы– соединения, в которых переходный металл образует связь с ионом металла или водорода и координированными карбониловыми группами (пентакарбонил кобальта [Co(CO)5]);
6) взаимодействуют с серой и сероводородом при нагревании, образуя сульфиды.
Железо– второй (после алюминия) по распространенности металл, встречается в виде различных руд, пригодных для переработки. Из них получают почти чистый Fe3O4, который вместе с известняком и коксом используется для выплавки чугуна в доменной печи.
Кобальтвыделяют из руд, содержащих много мышьяка и некоторой доли серебра, достаточной для промышленной переработки.
Никель– в руде много примесей: сульфиды никеля, меди и железа. Половина получаемого никеля расходуется в производстве стали для повышения ее коррозионной стойкости и твердости. Он используется также для создания прочных покрытий на стальных изделиях.
67. Железо
Железозанимает второе место после алюминия по распространенности в земной коре (~4 %). Содержится в виде соединений (оксиды, сульфиды и силикаты).
Руды, из которых получают железо – магнитный, красный, бурый и шпатовый железняки, реже – железный колчедан или пирит. Последний используют для получения серной кислоты.
Физические свойства. Температура плавления – 1539±5 °C. У железа существуют 2 кристаллические модификации: ?-железо ?-железо. Является пластичным металлом серебристого цвета. Хорошо поддается механической обработке. От чистоты железа зависят его механические свойства, а оно в твердой фазе способно растворять в себе элементы. Твердый раствор углерода в ?-железе – феррит, в ?-железе – аустенит. Такому раствору отвечает соединение цементит или карбид железа – вещество со сложной кристаллической структурой, большой твердостью и хрупкостью, имеет температуру плавления 1600 °C. Свойства таких растворов зависят от содержания в них углерода. Но, несмотря на концентрацию углерода, феррит и аустенит имеют меньшую твердость и пластичность, чем цементит.
Получение.Железо без примесей можно получить при восстановлении оксида железа (III) водородом при повышенной температуре. Сейчас существует немало методов, позволяющих получить железо, содержащее 10-6% примесей, но в практических целях используется железо в виде сплавов.
Черная металлургия занимается производством сплавов железа – чугунов и сталей, перерабатывающая – железных руд и сплавов. Обрабатывая руду, в первую очередь получают чугун, из которого потом получают сталь.
Стали– железоуглеродные сплавы, содержащие меньше 2,14 % углерода.
Чугуны– железоуглеродные сплавы, содержащие больше 2,14 % углерода.
Для того, чтобы получить чугун, используют руды, содержащие серу (гематит, магнетит, сидерит). Для доменных процессов не используют руду с малым содержанием серы (0,3 %), так как сера, переходя в железо, делает его ломким и хрупким.
Получаемый чугун содержит 93 % Fe, 7 % составляют C, Si, P и газовые включения (азот, кислород и др.). Для удаления примесей проводят обжиг в отражательных печах. Добавление определенных металлов придает сплаву твердость, вязкость, механическую прочность и другие физические свойства, необходимые для сталей. Затем полученный сплав подвергают операциям отжига и закалки для создания хорошей кристаллической структуры и распределения фаз.
Полученный чугун используют для:
1) переплавки в сталь в конвертерах, мартеновских или электрических дуговых печах;
2) литейный чугун используется в машиностроении для чугунного литья.
68. Соединения железа
Оксид железа (II) FeO– черное кристаллическое вещество, нерастворимое в воде и щелочах. FeOсоответствует основание Fe(OH)2.
Получение.Оксид железа (II) можно получить неполным восстановлением магнитного железняка оксидом углерода (II):

Химические свойства.Является основным оксидом. Реагируя с кислотами, образует соли:
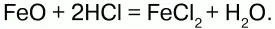
Гидроксид железа (II) Fe(OH)2– кристаллическое вещество белого цвета.
Получение.Гидроксид железа (II) получается из солей двухвалентного железапри действии растворов щелочей:
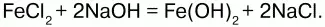
Химические свойства.Основный гидроксид. Вступает в реакции с кислотами:
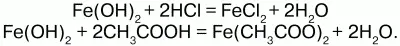
На воздухе Fe(OH)2 окисляется до Fе(ОН)3:
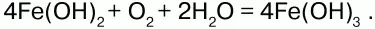
Оксид железа(III) Fe2O3– вещество бурого цвета, встречается в природе в виде красного железняка, нерастворим в воде.
Получение. При обжиге пирита:
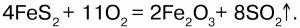
Химические свойства.Проявляет слабые амфотерные свойства. При взаимодействии со щелочами образует соли:

Гидроксид железа (III) Fe(OH)3– вещество красно-бурого цвета, нерастворимое в воде и избытке щелочи.
Получение. Получают путем окисления оксида железа (III) и гидроксида железа (II).
Читать дальшеИнтервал:
Закладка:









