В. Потапов - Пособие кислотчику сульфитно-целлюлозного производства
- Название:Пособие кислотчику сульфитно-целлюлозного производства
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
В. Потапов - Пособие кислотчику сульфитно-целлюлозного производства краткое содержание
Данное пособие создано для специалистов совершенствующих свое мастерство на целлюлозно-бумажных комбинатах.
Если Вам понравилось и помогло это пособие, и хотите получить другие в fb-2 — обращайтесь: rudolf.karpov@yandex.ru.
Пособие кислотчику сульфитно-целлюлозного производства - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Ожидаемый эффект очистки в сухом электрофильтре может быть определен по формуле
η = I — K L,
I = L/Sω r- удельное время пребывания газа в электрофильтре (параметр, характеризующий режим работы электрофильтра), сек/м;
ω r- скорость газа в активной зоне электрофильтра (0,5 м/сек);
L = nl — суммарная активная длина полей l электрофильтра по ходу газа, м;
n — число полей;
S — Расстояние между осадительными и коронирующими электродами (для электрофильтров типа ОГ S=0,13 м);
K — коэффициент, характеризующий скорость осаждения частиц пыли в электрическом поле.
Для электрофильтров типа ОГ при работе на колчеданной пыли К=0,95.
Охлаждение печного газадо температуры 35–40° производится в две стадии. Сначала газ быстро охлаждают до температуры 450–500°, в случае работы на колчедане, и до 300 °C, в случае работы на сере, чтобы уменьшить возможность образования SO 3.
Вторая стадия — охлаждение газа с температурой 300–500° до температуры 35–40°.
Не следует охлаждать газ в первой стадии до температуры ниже 300 °C, так как в этом случае происходит конденсация серной кислоты, которая может подвергнуть разрушению оборудование.
Более интенсивно процесс охлаждения газа за счет непосредственного контакта газа с жидкостью проходит в барботажных и пенных аппаратах с перфорированной решеткой. Кроме того, охлаждение газа может происходить и через разделяющую стенку. Наиболее старым способом такого рода охлаждения являются свинцовые погружные холодильники, в которых охлаждающей средой служит вода. Для охлаждения используются и трубчатые холодильники, в которых охлаждающим элементом является атмосферный воздух.
Поглощение сернистого газа и получение сырой кислоты
До недавнего времени для варки сульфитной целлюлозы применяли кислоту только на кальциевом основании. Существовало два способа получения сырой кислоты: турменный и известково-молочный. В настоящее время все большее значение приобретают другие виды основания — магниевое, натриевое, аммониевое, которые применяются в чистом виде или в смеси с кальциевым основанием В основе приготовления сырой кислоты любого состава и с любым видом основания лежит процесс абсорбции.
Абсорбция — это процесс поглощения газа за счет проникновения его в массу жидкости, в результате чего происходит образование раствора определенного состава.
При соприкосновении газа с жидкостью часть молекул газа растворяется в ней, а затем частично выделяется обратно в газовую фазу, При этом через некоторое время количество молекул, переходящих в жидкость и возвращающихся в газовую фазу, становится одинаковым. Такое положение называется состоянием равновесия. Содержанию растворенного газа в жидкости при данной температуре соответствует определенное содержание его в газовой фазе, которое называется парциальным давлением.
Парциальное давление газа над жидкостью выражается обычно в мм рт. ст. или в ата и составляет часть общего давления над данным раствором. Следовательно, на процесс абсорбции газа жидкостью влияют два основных фактора — парциальное давление и температура, меняя которые можно регулировать состав раствора.
Таким образом, если печной газ с определенным содержанием сернистого ангидрида в нем С% и под некоторым давлением p мм рт. ст. вступает в соприкосновение с водой, имеющей температуру t°С, растворимость газа в воде X определяется по формуле Гумма, как
X = 0.03Cp / (100x1.0363 t) %.
Из приведенной формулы исходят следующие основные выводы:
1. С повышением давления растворимость SO 2в воде повышается. Это объясняется тем, что с повышением общего давления растет и парциальное давление, составляющее часть общего, а с повышением парциального давления газа над его раствором состояние равновесия смещается в сторону увеличения количества поглощенного газа.
2. Чем выше концентрация SO 2в поступающем газе (т. е. выше парциальное давление), тем большее его количество может перейти в раствор.
3. С повышением температуры раствора количество SO 2, способного раствориться, понижается.
Процесс поглощения сернистого газа водой сопровождается химической реакцией образования сернистой кислоты
SO 2+ H 2O ↔ H 2SO 3.
Количество сернистой кислоты при 10° составляет 80 % от всего растворенного SO 2. С повышением температуры равновесие реакции смещается влево и при 90° сернистой кислоты содержится всего 10 %.
Максимальная концентрация SO 2в воде при атмосферном давлении 22,8 %. Повышая давление, можно довести концентрацию до 24–25 % SO 2. При дальнейшем повышении содержания SO 2раствор распределяется на два слоя: нижний — жидкий 98,6 % SO; и верхний раствор, содержащий 24–25 % SO 2. Повысить содержание SO 2до 29,2 % можно охлаждением раствора до -3°. При температуре -3,5° раствор замерзает. Однако растворы указанных выше концентраций практического применения не имеют. Обычно концентрация водного раствора SO 2, используемого, например, на второй ступени варки ацетатной целлюлозы, не превышает 7–10 %.
Варочная кислота для кислой сульфитной варки состоит из бисульфитного раствора и свободного SO 2, а для бисульфитной арки — без свободного SO 2, поэтому в производственных условиях приходится иметь дело с абсорбцией SO 2растворами бисульфита.
Естественно, что в данном случае на насыщение растворов оказывает влияние, кроме температуры, давления и концентрации SO 2, концентрация самого бисульфита. На рис. 6 приведена номограмма для определения теоретического содержания всего SO 2в кислоте (т. е. того количества SO 2, которое может быть поглощено при заданной температуре кислоты), содержание CaO в ней и концентрации SO 2в газе (парциальном давлении). По номограмме находим (пунктирная линия), что при температуре 25° и парциальном давлении 0,1 ата (концентрация печного газа 10 %) в растворе, содержащем 1,2 % CaO, может раствориться 3,44 % SO 2. Подобным образом по номограмме может быть определен состав сырой кислоты при разных условиях.
Из номограммы видно, что с повышением количества основания в кислоте растворимость SO 2в растворе бисульфита возрастает. Однако одновременно с этим содержание свободного SO 2уменьшается. Так, в приведенном выше случае при содержании в растворе 1,37 % связанного SO 2(1,2 % CaO) в виде бисульфита Ca(HSO 3) 2будет находиться 2,74 % SO 2, а свободного SO 21,7 %. При тех же условиях, но при содержании связанного SO 21,6 % (1,4 % CaO) или 3,2 % в виде бисульфита, общее SO 2будет составлять 3,92 %, т. е. растворенного SO 2из них всего 0,72 %.
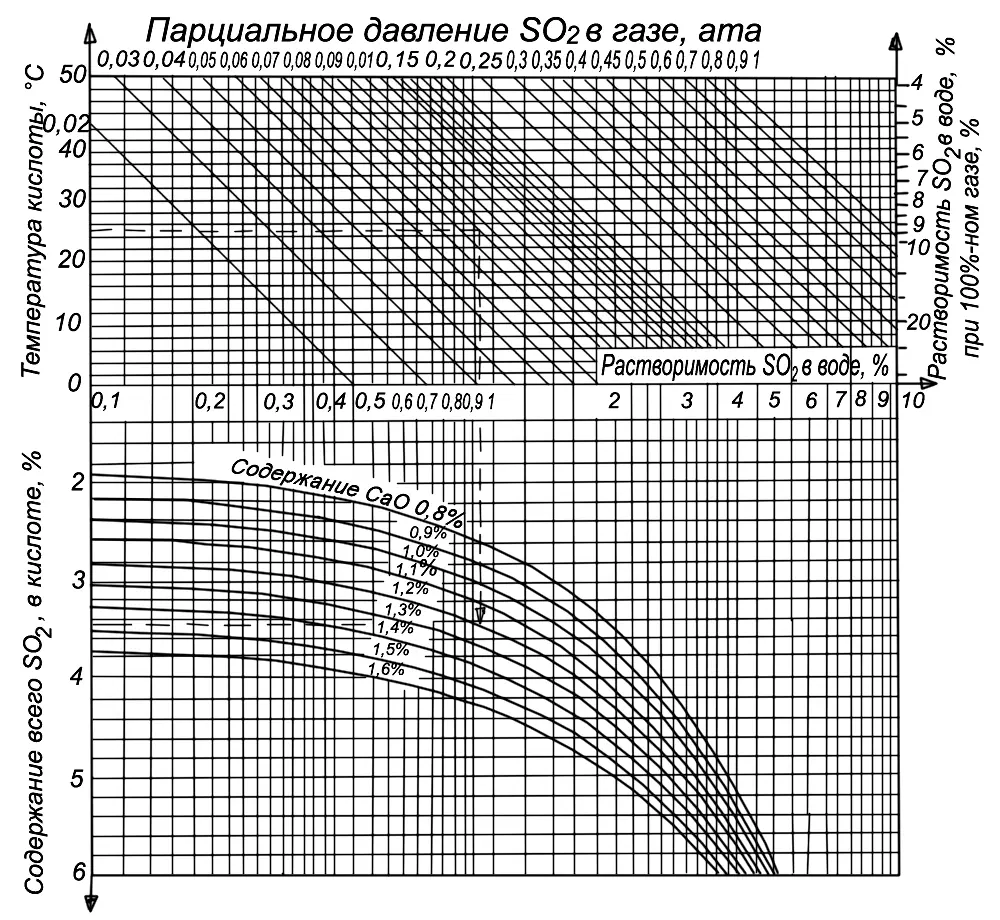
Рис 6. Номограмма для определения содержания SO 2в башенной кислоте.
Дальнейшее увеличение содержания основания в кислоте при данном парциальном давлении возможно только до некоторого предела, называемого равновесным состоянием. Переход через его границы вызовет выпадение из раствора моносульфита CaSO 3. Для устойчивости бисульфита кальция в растворе обязательным является наличие некоторого избытка свободного SO 2, соотношение между общим и связанным SO 2всегда должно быть больше 2.
Читать дальшеИнтервал:
Закладка:









