Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Чистый карборунд — бесцветные очень твердые кристаллы (плотность 3,2 г/см 3). Технический продукт обычно окрашен примесями в темно-серый цвет.
По внутреннему строению карборунд представляет собой как бы алмаз, в котором половина атомов углерода равномерно заменена атомами кремния. Каждый атом углерода находится в центре тетраэдра, в вершинах которого расположены атомы кремния; в свою очередь каждый атом кремния окружен подобным же образом четырьмя атомами углерода. Ковалентные связи, соединяющие все атомы в этой структуре, как и в алмазе, очень прочны. Этим объясняется большая твердость карборунда.
Карборунд получают в больших количествах; применение его разнообразно и связано с его высокой твердостью и огнеупорностью. Из порошка карборунда изготовляют шлифовальные круги, бруски, шлифовальную бумагу. На его основе производят плиты для сооружения полов, платформ и переходов в метро и на вокзалах. Из него готовят муфели и футеровку для различных печей. Смесь порошков карборунда и кремния служит материалом для изготовления силитовых стержней для электрических печей.
При высокой температуре кремний вступает в соединение со многими металлами, образуя силициды. Например, при нагревании диоксида кремния с избытком металлического магния восстанавливающийся кремний соединяется с магнием, образуя силицид магния Mg 2Si:
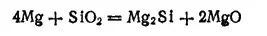
- 494 -
179. Соединения кремния с водородом и галогенами.
При действии соляной кислоты на силицид магния Mg 2Si получается кремневодород (силан) SiH 4, подобный метану:
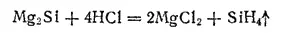
Силан SiH 4бесцветный газ, самовоспламеняющийся на воздухе и сгорающий с образованием диоксида кремния и воды:
SiH 4+ 2O 2= SiO 2+ 2H 2O
Кроме SiH 4, известно несколько других кремневодородов, которые носят общее название силанов, например дисилан Si 2H 6, трисилан Si 3H 8. Силаны аналогичны углеводородам, но отличаются от них малой стойкостью. Очевидно, что связь между атомами кремния гораздо менее прочна, чем связь между атомами углерода, вследствие чего цепи —Si—Si—Si— легко разрушаются. Непрочна также связь кремния с водородом, что указывает на значительное ослабление у кремния неметаллических свойств.
Хлорид кремния SiCl 4получается нагреванием смеси диоксида кремния с углем в струе хлора:
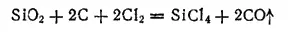
или хлорированием технического кремния. Он представляет собой жидкость, кипящую при 57°C.
При действии воды хлорид кремния подвергается полному гидролизу с образованием кремниевой и соляной кислот:
SiCl 4+ 3H 2O = H 2SiO 3+ 4HCl
Вследствие этой реакции при испарении SiCl 4во влажном воздухе образуется густой дым. Хлорид кремния применяется для Синтеза кремнийорганических соединений.
Фторид кремния SiF 4образуется при взаимодействии фтороводорода с диоксидом кремния;
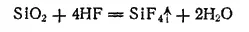
Это — бесцветный газ с резким запахом.
Как и хлорид кремния, в водных растворах SiF 4гидролизуется:
SiF 4+ 3H 2O = H 2SiO 3+ 4HF
Образующийся фтороводород взаимодействует с SiF 4. При этом получается гексафторокрвмниевая (или кремнефтористоводородная) кислота H 2SiF 6:
SiF 4+ 2HF = H 2SiF 6
Суммарный процесс выражается уравнением:
3SiF 4+ 3H 2O = H 2SiF 6+ H 2SiO 3
- 495 -
По силе гексафторокремниевая кислота близка к серной. Соли ее — кремнефториды, или фторосиликаты, в большинстве своем растворимы в воде; малорастворимы соли натрия, калия, рубидия, цезия, практически нерастворима соль бария. Сама кислота и все фторосиликаты ядовиты.
Фторосиликат натрия Na 2SiF 6применяется в качестве инсектицида, а также входит в состав смесей для производства цементов и эмалей. Растворимые фторосиликаты магния, цинка, алюминия применяют в строительстве. Эти вещества делают поверхность строительного камня — известняка, мрамора — водонепроницаемой. Такое их действие объясняется образованием малорастворимых фторидов и кремнезема.
180. Диоксид кремния.
Наиболее стойким соединением кремния является диоксид кремния, или кремнезем, SiO 2. Он встречается как в кристаллическом, так и в аморфном виде.
Кристаллический диоксид кремния находится в природе главным образом в виде минерала кварца. Прозрачные, бесцветные кристаллы кварца, имеющие форму шестигранных призм с шестигранными пирамидами на концах, называются горным хрусталем (рис. 134). Горный хрусталь, окрашенный примесями в лиловый цвет, называется аметистом, а в буроватый — дымчатым топазом. Но чаще кварц встречается в виде сплошных полупрозрачных масс, бесцветных или окрашенных в разные цвета. Одной из разновидностей кварца является кремень. К мелкокристаллическим разновидностям кварца относятся агат и яшма. Кварц входит также в состав многих сложных горных пород, например гранита и гнейса.
Из мелких зерен кварца состоит обычный песок. Чистый песок— белого цвета, но чаще он бывает окрашен соединениями железа в желтый или красноватый цвет.
Кристаллический диоксид кремния очень тверд, нерастворим в воде и плавится около 1610°C, превращаясь в бесцветную жидкость. По охлаждении этой жидкости получается прозрачная стекловидная масса аморфного диоксида кремния, по виду сходного со стеклом.
Аморфный диоксид кремния распространен в природе гораздо меньше, чем кристаллический. На дне морей имеются отложения тонкого пористого аморфного кремнезема, называемого трепелом или кизельгуром. Эти отложения образовались из входившего в состав организмов диатомовых водорослей и некоторых инфузорий.

Рис. 134. Кристаллы горного хрусталя.
- 496 -
Кислоты, за исключением плавиковой, не действуют на диоксид кремния. Плавиковая же кислота легко вступает с ним в реакцию, образуя фторид кремния и воду (см. стр. 350).
Кремнезем в виде песка широко применяется в строительстве, в производстве стекла (см. § 182), керамики (см. § 183), цемента (см. § 184), абразивов. Особая область применения кварца связана с тем, что он способен деформироваться под действием электрического поля. Это свойство кристаллов кварца используется в звукозаписывающей и звуковоспроизводящей аппаратуре и для генерации ультразвуковых колебаний.
181. Кремниевые кислоты и их соли.
Интервал:
Закладка:








