Ричард Фейнман - Фейнмановские лекции по физике. Современная наука о природе [litres]
- Название:Фейнмановские лекции по физике. Современная наука о природе [litres]
- Автор:
- Жанр:
- Издательство:Литагент АСТ
- Год:2019
- Город:Москва
- ISBN:978-5-17-113087-9
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ричард Фейнман - Фейнмановские лекции по физике. Современная наука о природе [litres] краткое содержание
Фейнмановские лекции по физике. Современная наука о природе [litres] - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
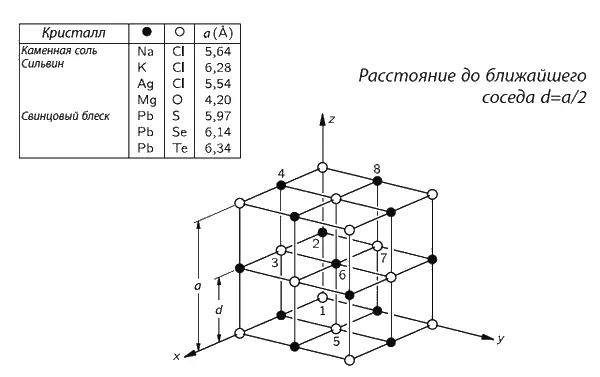
Фиг. 1.7. Структура кристалла соли.
Строго говоря, кристалл состоит не из атомов, а из ионов . Ионы – это атомы с излишком или с нехваткой электронов. В кристалле соли мы находим ионы хлора (атомы хлора с лишним электроном) и ионы натрия (атомы натрия, лишенные одного электрона). Ионы в твердой соли скреплены друг с другом электрическим притяжением, но в воде некоторые из них, притянувшись к положительному водороду или отрицательному кислороду, начинают свободно двигаться. На фиг. 1.6 виден освободившийся ион хлора и другие атомы, плавающие в воде в виде ионов. На рисунке нарочно подчеркнуты некоторые детали процесса. Заметьте, например, что водородные концы молекул воды обычно обступают ион хлора, а возле иона натрия чаще оказывается кислород (ион натрия положителен, а атом кислорода в молекуле воды отрицателен, поэтому они притягиваются). Можно из рисунка понять: растворяется здесь соль в воде или же выкристаллизовывается из воды? Ясно, что нельзя; часть атомов уходит из кристалла, часть присоединяется к нему. Процесс этот динамический , подобный испарению; все зависит от того, много или мало соли в воде, в какую сторону нарушено равновесие. Под равновесным понимается такое состояние, когда количество уходящих атомов равно количеству приходящих. Если в воде почти нет соли, то больше атомов уходит в воду, чем возвращается из воды: соль растворяется. Если же «атомов соли» слишком много, то приход превышает уход и соль выпадает в кристаллы.
Мы мимоходом упомянули, что понятие молекулы вещества не совсем точно и имеет смысл только для некоторых видов веществ. Оно применимо к воде, в ней действительно три атома всегда скреплены между собой, но оно не очень подходит к твердому хлористому натрию. Хлористый натрий – это ионы хлора и натрия, образующие кубическую структуру. Нельзя естественным путем сгруппировать их в «молекулы соли».
Вернемся к вопросу о растворении и осаждении соли. Если повысить температуру раствора соли, то возрастет и число растворяющихся атомов и число осаждаемых. Оказывается, что в общем случае трудно предсказать, в какую сторону сдвинется процесс, быстрей или медленней пойдет растворение. С ростом температуры большинство веществ начинает растворяться сильней, а у некоторых растворимость падает.
§ 4. Химические реакции
Во всех описанных процессах атомы и ионы не меняли своих напарников. Но, конечно, возможны обстоятельства, в которых сочетания атомов меняются, образуя новые молекулы. Это показано на фиг. 1.8. Процесс, в котором атомные партнеры меняются местами, называется химической реакцией . Описанные нами прежде процессы называются физическими, но трудно указать резкую границу между теми и другими. (Природе все равно, как мы это назовем, она просто делает свое дело.) На картинке мы хотели показать, как уголь горит в кислороде. Молекула кислорода состоит из двух атомов, сцепленных очень крепко. (А почему не из трех или даже не из четырех ? Такова одна из характерных черт атомных процессов: атомы очень разборчивы, им нравятся определенные партнеры, определенные направления и т. д. Одна из обязанностей физики – разобраться, почему они хотят именно то, что хотят. Во всяком случае два атома кислорода, довольные и насыщенные, образуют молекулу.)
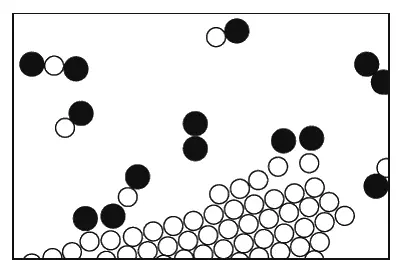
Фиг. 1.8. Уголь, горящий в кислороде.
Предположим, что атомы углерода образуют твердый кристалл (графит или алмаз [1] Алмаз тоже может сгореть в воздухе.
). Одна из молекул кислорода может пробраться к углероду, каждый ее атом подхватит по атому углерода и улетит в новом сочетании углерод – кислород. Такие молекулы образуют газ, называемый угарным. Его химическое имя СО. Что это значит? Буквы СО – это фактически картинка такой молекулы: С – углерод, О – кислород. Но углерод притягивает к себе кислород намного сильнее, чем кислород притягивает кислород или углерод – углерод. Поэтому кислород для этого процесса может поступать с малой энергией, но, схватываясь с неимоверной жадностью и страстью с углеродом, высвобождает энергию, поглощаемую всеми соседними атомами. Образуется большое количество энергии движения (кинетической энергии). Это, конечно, и есть горение; мы получаем тепло от сочетания кислорода и углерода. Теплота в обычных условиях проявляется в виде движения молекул нагретого газа, но иногда ее может быть так много, что она вызывает и свет . Так получается пламя.
Вдобавок молекулы СО могут не удовольствоваться достигнутым. У них есть возможность подсоединить еще один атом кислорода; возникает более сложная реакция: кислород в паре с углеродом столкнется с другой молекулой СО. Атом кислорода присоединится к СО и в конечном счете образуется молекула из одного углерода и двух кислородов. Ее обозначают СО 2и называют углекислым газом. Когда углерод сжигают очень быстро (скажем, в моторе автомашины, где взрывы столь часты, что углекислота не успевает образоваться), то возникает много угарного газа. Во многих таких перестановках атомов выделяется огромное количество энергии, наблюдаются взрывы, вспыхивает пламя и т. д.; все зависит от реакции.
Химики изучили эти расположения атомов и установили, что любое вещество – это свой тип расположения атомов.
Чтобы объяснить эту мысль, рассмотрим новый пример. У клумбы фиалок вы сразу чувствуете их «запах». Это значит, что в ваш нос попали молекулы , или расположения атомов особого рода. Как они туда попали? Ну, это просто. Раз запах – это молекулы особого рода, то, двигаясь и сталкиваясь повсюду, они случайно могли попасть и в нос. Конечно, они не стремились попасть туда. Это просто беспомощные толпы молекул, и в своих бесцельных блужданиях эти осколки вещества, случается, оказываются и в носу.
И вот химики могут взять даже такие необычные молекулы, как молекулы запаха фиалок, проанализировать их строение и описать нам точное расположение их атомов в пространстве. Мы, например, знаем, что молекула углекислого газа пряма и симметрична: О-С-О (это легко обнаружить и физическими методами). Но и для безмерно более сложных, чем те, с которыми имеет дело химия, расположений атомов можно после долгих увлекательных поисков понять, как выглядит это расположение. На фиг. 1.9 изображен воздух над фиалками.
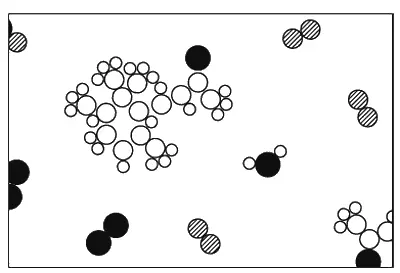
Фиг. 1.9. Запах фиалки.
Читать дальшеИнтервал:
Закладка:
![Обложка книги Ричард Фейнман - Фейнмановские лекции по физике. Современная наука о природе [litres]](/books/1068056/richard-fejnman-fejnmanovskie-lekcii-po-fizike-sov.webp)




![Пол Халперн - Квантовый лабиринт. Как Ричард Фейнман и Джон Уилер изменили время и реальность [litres]](/books/1082376/pol-halpern-kvantovyj-labirint-kak-richard-fejnman.webp)
