Айзек Азимов - Популярная физика. От архимедова рычага до квантовой механики
- Название:Популярная физика. От архимедова рычага до квантовой механики
- Автор:
- Жанр:
- Издательство:Центрполиграф
- Год:2006
- Город:М.
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Айзек Азимов - Популярная физика. От архимедова рычага до квантовой механики краткое содержание
Популярная физика. От архимедова рычага до квантовой механики - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Так как атомное число изотопов одного и того же элемента одинаково, химики решили на письме отображать лишь их атомные веса: торий–234 и торий–232, или, более кратко, Th 232и Th 234.
С точки зрения химии вполне обоснованно помещать изотопы в одну и ту же ячейку периодической таблицы. Торий–234 и торий–232 имеют в ядре по 90 протонов и соответственно по 90 электронов в нейтральном атоме. Химические свойства элементов определяются распределением электронов по электронным уровням, а значит, химические свойства этих двух изотопов тория, как и изотопов любых других элементов, будут одинаковыми [131] Впрочем, небольшие различия в химических свойствах все же есть. Это особенно характерно для атомов легких элементов, так как один изотоп такого элемента тяжелее другого и поэтому проявляет меньшую активность. Однако эта разница настолько незначительна, что в большинстве случаев ею можно пренебречь.
.
Но, несмотря на то что у атомов изотопов на энергетических уровнях один и тот же набор электронов, они все же отличаются структурой атомных ядер. Количество протонов в ядре изотопов одинаково, значит, неодинаково количество нейтронов. Например, ядро атома тория–234 состоит из 90 протонов и 144 нейтронов, в то время как ядро атома тория–232 состоит из 90 протонов и 142 нейтронов.
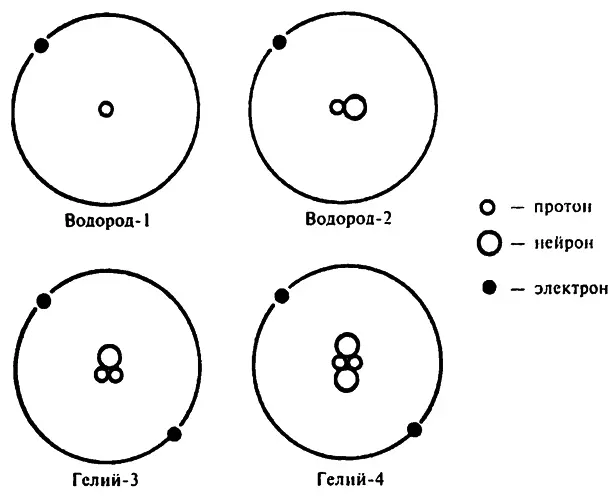
Когда речь идет об изменениях внутри атомного ядра, например когда мы говорим о радиоактивности (в то время как во время химических преобразований изменяется лишь число электронов, атомное ядро остается неизменным), различия в количестве нейтронов в ядре очень важны.
Итак, процесс распада тория–232 идет очень медленно, именно поэтому этот элемент до сих пор присутствует в земной коре. Атом тория испускает альфа-частицу и его атомное число падает до 88, т. е. до радия. Запишем это:
С другой стороны, процесс распада атомов тория–234 идет крайне быстро, и именно поэтому в природе этот элемент встречается только в исчезающе малых количествах в урановой руде. Более того, при распаде тория–234 выделяется бета-частица, что приводит к увеличению атомного числа до 91, то есть до протактиния:
После выхода альфа- или бета-частицы может образоваться новый атом, заряд ядра которого будет выше, чем у атома основного состояния. После возврата в прежнее состояние атом испускает гамма-луч. В некоторых случаях это происходит не сразу, атом существует какое-то время, а радиационное излучение его возбужденного ядра обладает уникальными характеристиками. Для обозначения наличия возбужденного ядра символ элемента помечают звездочкой. В процессе образования протактиния–234 его ядро переходит в возбужденное состояние:
В 1936 году Лизе Майтнер предложила называть атомы с одинаковыми атомными числами и атомными весами, но различающиеся структурой ядра, изомерами. Первый случай ядерной изомерии был зафиксирован на примере протактиния–234 еще в 1921 году Отто Ганом, давним партнером Майтнер по работе.
Радиоактивные ряды
Закон Содди привел к отказу от собственных названий различных атомов, образующихся из урана и тория. Эти названия представляют определенный исторический интерес, поэтому их можно встретить в книгах по истории физики, но в этой книге мы будем обозначать эти элементы исключительно как изотопы. Как только мы правильно обозначим все эти элементы, окажется, что, несмотря на то что уран и торий образуют десятки изотопов, их все можно разместить в той или иной ячейке периодической таблицы.
В табл. 5 все вышесказанное проиллюстрировано на примере изотопов так называемого уранового ряда, то есть элементов, образующихся из урана–238.
Стоит подробнее ознакомиться с элементами этого ряда, как возникает несколько вопросов. Например, свинец–206 является стабильным изотопом и не подвергается радиоактивному распаду, поэтому этот элемент и заканчивает урановый ряд. Однако существуют и такие изотопы, как свинец–214 и свинец–210, и они являются радиоактивными элементами. Это говорит о том, что изотопы не обязательно являются радиоактивными, у одного и того же элемента могут быть как радиоактивные, так и устойчивые изотопы.
Если не принимать во внимание свинец–206, то процесс распада всех этих элементов, за исключением урана–238, идет с относительно высокой скоростью. Следовательно, с момента образования Земли до наших дней дошел только уран–238. Этот элемент является «родителем» всего уранового ряда, и если бы урана–238 сегодня не существовало, то не существовало бы и всех его дочерних элементов.
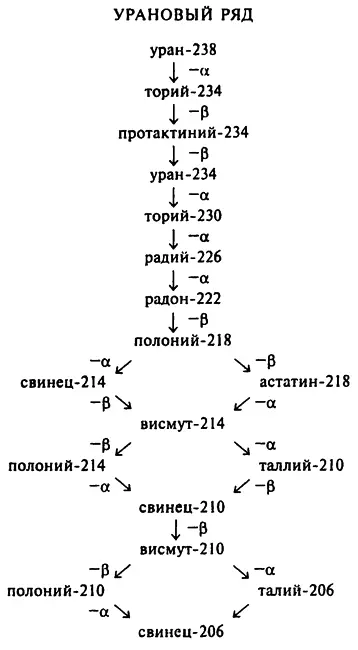
Атомы некоторых радиоактивных элементов могут образовывать разные цепочки изотопов. К примеру, полоний–218 может испускать альфа-частицы свинца–214 или же бета-частицу астатина–218. Это пример так называемого разветвленного распада. Как правило, преобладает какой-то один вариант распада. Например, лишь каждые 2 из 10 000 атомов полония–218 распадаются до астатина–218, все остальные распадаются до свинца–214. (То есть в этом случае преобладает эмиссия альфа-частиц, в других же случаях может преобладать и эмиссия бета-частиц.)
Астатин (атомное число 85) если и образуется во время радиоактивного распада, то обычно в самом конце цепочки превращений. Именно поэтому его количество настолько ничтожно мало, что ученые очень долго не могли его обнаружить. То же можно сказать и о франции (атомное число 87), с той лишь разницей, что франций в некоторых цепочках вообще не образуется.
Атомный вес любого атома радиоактивного семейства либо вообще не меняется (как в случае выхода бета-частицы или гамма-луча), либо уменьшается на 4 (как в случае выхода альфа-частицы). Это означает, что значение разницы атомных весов двух любых элементов ряда либо равно нулю, либо кратно 4.
Атомный вес урана–238 равняется 238. Разделив 238 на 4, получаем 59 и 2 в остатке. При делении любого числа, отличного от 238 и кратного 4, на 4 всегда будет оставаться остаток 2. Значение атомного веса любого члена уранового ряда можно вычислить по формуле 4x + 2, где он может принимать любое значение от x = 59 — для урана–238 и x = 51 — для свинца–206. По этой причине урановый ряд иногда называют рядом 4x + 2.
Читать дальшеИнтервал:
Закладка:









