Эрик Роджерс - Физика для любознательных. Том 1. Материя. Движение. Сила
- Название:Физика для любознательных. Том 1. Материя. Движение. Сила
- Автор:
- Жанр:
- Издательство:Мир
- Год:1969
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Эрик Роджерс - Физика для любознательных. Том 1. Материя. Движение. Сила краткое содержание
Физика для любознательных. Том 1. Материя. Движение. Сила - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Вот типичные результаты измерений (это не подлинные данные Адама, но они основаны на его записях):
Бензольный раствор. Состав: 4 г пальмитиновой кислоты растворены в 996 г бензола. Следовательно, каждый килограмм раствора содержит 0,004 кг пальмитиновой кислоты.
Размер капель. В сосуд капают 100 капель раствора и сосуд взвешивают.
Масса 100 капель раствора равна 0,33 г, или 0,00033 кг.
Основной опыт. На воду наносят 5 капель раствора. Когда бензол испаряется (остается невидимая нерастворимая поверхностная пленка пальмитиновой кислоты), брусок А двигают по направлению к бруску В . Последний испытывает сильный толчок, когда расстояние между А и В составляет 0,23 м. В этот момент поверхность воды между брусками составляет 0,23 м в длину и 0,14 м в ширину.
Плотность пальмитиновой кислоты (в виде жидкости) составляет 850 кз/м 3, (0,85 по сравнению с водой).
Задание: предполагая, что пленка пальмитиновой кислоты имеет ту же плотность, с помощью приведенной ниже инструкции определите размеры ее молекул.
1) Рассчитайте длину молекул, используя снова предположение Ралея.
[ Примечание. Даже одна арифметическая ошибка может превратить решение этой задачи в бессмыслицу. Расчет объема взятого масла (пальмитиновой кислоты) является простой задачей на дроби, подобно расчету рецепта теста для пирога или разбавления соков. Он требует знания элементарных арифметических правил и уверенности. Чтобы избежать ошибок, лучше производить его по стадиям, например, по количеству раствора (5 капель), нанесенного на воду, рассчитать:
а) массу нанесенного на воду раствора;
б) массу пальмитиновой кислоты, содержащейся в этом количестве раствора;
в) объем, который займет эта масса пальмитиновой кислоты (850 кг занимают 1 м 3, следовательно…).]
2) Оцените ширину молекул с помощью следующего рассуждения. Цепная формула изображает молекулу в 19 атомов длиной и только несколько атомов шириной. Трудно догадаться о форме поперечного сечения молекулы; атомы Н должны быть меньше, чем атомы С в цепи. Возможно, что поперечное сечение содержит 3 атома в ширину и один в толщину, либо чередующиеся связи могут колебаться в разные стороны, делая поперечное сечение квадратом, скажем, со сторонами по 3 атома.
В качестве грубого предположения [83] Для ориентировочной оценки массы одной молекулы могут делаться даже еще более грубые предположения.
, допустим, что поперечное сечение является квадратом со стороной от 1,5 до 3 атомов. Забывая, что разные атомы имеют разные размеры, мы заключаем, что ширина молекулы должна быть где-то между 1/ 10 и 1/ 5ее 19-атомной длины. Глупо было бы пытаться сузить эти пределы (фиг. 132).
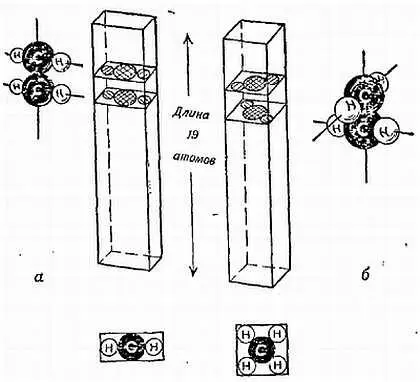
Фиг. 132. Схема к рассуждению о форме молекулы пальмитиновой кислоты.
Современные химики, группируя атомы углерода и водорода в молекулы, приписывают им четкие размеры, причем углероду намного больше, чем водороду. Здесь показаны ранние предположения о размерах атомов, и атом С изображен лишь немного больше атома Н . Каково поперечное сечение: «продолговатое» ( а ) или «квадратное» ( б )?
Рассчитайте объем молекулы пальмитиновой кислоты, для этого возьмите длину, полученную в п. 1, и считайте поперечное сечение квадратом со стороной, равной 1/ 10длины. Повторите вычисление с другим пределом — 1/ 5длины.
3) Принимая плотность равной 850 кг/м 3, рассчитайте массу одной молекулы на основе каждого предположения ( 1/ 10 и 1/ 5). (Если 850 кг занимают 1 м 3, то…)
4) Простые химические измерения (анализ путем сжигания и взвешивания и т. д.) говорят, что масса молекулы пальмитиновой кислоты в 256 раз больше массы атома водорода. (Химические опыты не могут дать действительных значений масс отдельных атомов и молекул, но позволяют легко определить их относительные величины.) На основании полученного вами результата рассчитайте массу одного атома водорода (при каждом предположении — 1/ 10 и 1/ 5).
5) На основании п. 4 скажите приблизительно, сколько атомов должно быть в 1 кг водорода (около 11 м3 при атмосферном давлении).
6) Сейчас существуют совершенно другие способы определения массы атома водорода (косвенные, но надежные, использующие электрический заряд электрона или некоторые измерения радиоактивности). Они дают:
МАССА АТОМА ВОДОРОДА = 1,66∙10 -27кг.
Предположите, что правильно это значение, и проделайте вычисление в обратном порядке. Что теперь можно сказать о форме молекулы пальмитиновой кислоты? Были ли допущения 1/ 10 и 1/ 5близки к истине?
( Примечание . Проделать детально всю работу в обратном порядке может оказаться утомительным. Можно ограничиться сокращенными выкладками.)
Задача 7. Цепные молекулы
Измерения с помощью бруска и весов, подобные описанным в задаче 6 , дают следующие оценки для длины молекул нескольких членов ряда жирных кислот. Длина дается в специальных единицах (часто используемые в атомной физике единицы Ангстрема, равные 10 -10м).

( Примечание. Указанное число групп включает первый атом углерода с тремя атомами водорода.)
Подтверждают ли эти опыты идею о цепных молекулах? Проанализируйте их о помощью графика.
Физическая проверка химической картины
Только плохой преподаватель льстит себя надеждой, что способен объяснить, что такое молекулы масла, с помощью одних разговоров о «цепях связей» или «ворсе бархата» в тонких пленках. Однако если после вычислений, подобных приведенным выше, у вас появилось чувство, что вы что-то понимаете, то вы делаете гениальные успехи в науке. Использованные нами структурные формулы были остроумными догадками, сделанными по косвенным химическим соображениям. Они оставались совершенно непроверенными, пока метод Рэлея не дал в высшей степени удовлетворительное подтверждение существования длинных тонких молекул с одинаковым увеличением длины на каждую группу СН 2.
Все же рассуждения Рэлея допускали определенный риск; были желательны независимые измерения. В наше время еще более тонким средством измерения размеров молекул стали рентгеновские лучи. Превращая масла в воски путем замораживания, мы можем заставить слои молекул в кристаллах отражать рентгеновские лучи и по отражению рентгеновских лучей можем определить расстояние между слоями (или размер молекул), подобно тому как физики во времена Рэлея могли определить расстояние между жилками на крыльях бабочки по цветам отраженного света [84] Цвета мыльных пузырей тоже можно использовать для определения их толщины.
.
Интервал:
Закладка:










