Константин Ефанов - Вопросы теоретической термодинамики
- Название:Вопросы теоретической термодинамики
- Автор:
- Жанр:
- Издательство:Array SelfPub.ru
- Год:2021
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Константин Ефанов - Вопросы теоретической термодинамики краткое содержание
Вопросы теоретической термодинамики - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Теплосодержание в формуле
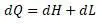
входит в теплосодержание энтальпии.
А уравнение энтальпии выводится из уравнения Клазиуса
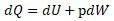
Вывод дан Клазиусом, в котором Клазиус для работы W установил выражение
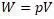
Эта путаница в терминах вносит существенные неудобства при анализе работ авторов.
Некоторые авторы объясняют физический смысл энтальпии как энергию расширенной системы – рабочего тела в цилиндре и массы груза (давления) над поршнем. Это объяснение выглядит некорректным, так как Клазиус выводил работу систему против внешних сил.
Гиббс определил энтальпию как тепловую функцию системы, но не энергию расширенной системы. Все объяснения имеют определенное обоснование и имеют место быть.
Энергии Гельмгольца
Энергия Гельмгольца применяется для описания изотермических процессов. Гельмгольц так же как Клазиус разделил энергию на свободную и связанную:
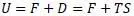
Гельмгольц считал, что в работу может перейти только свободная энергия, связанная энергия находится в виде теплоты и не преобразуется. И произведенная работа равна разности свободных энергий.
Энергия Гельмгольца (изохорно-изотермический потенциал) или по Гиббсу силовая функция системы:
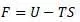
Отметим, что под обозначением U в формуле Гельмгольца является полная энергия (делящаяся им на свободную и связанную), а в работе Клазиуса энергия U является только внутренней энергией (состоит из теплосмодержания и внутренней работы):
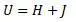
То есть физические величины, стоящие под знаком « U » в формулах Гельмгольца и Клазиуса являются разными физическими величинами.
Но в процессе без изменения объема при W = 0 в формуле Клаузиуса величина под «U» приобретает физический смысл полной энергии системы. Но при этом изначальный смысл заложенный в формуле Клазиуса для «U» является другим.
При W = 0 формула Клазиуса записывается в виде:
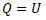
Это важно отметить во избежание путаницы.
__
Выполним совместное прочтение уравнений Клазиуса и Гельмгольца.
Обозначения Q и D относятся к теплоте, но имеют разную величину. Покажем это. Для этого приравняем уравнения Гельмгольца и Клазиуса. Основанием для приравнивания является то, что при W = 0 в уравнении Клазиуса по факту энергия «U» показывает полную энергию системы.
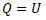
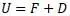
После подстановки:
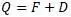
Как видим, величины теплот Q и D отличаются на величину свободной энергии.
Величина D определяется по уравнению Клазиуса для теплоты через энтропию так как D является теплотой (но отличающейся по величине от Q):
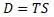
Уравнение Гельмгольца
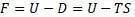
можно переписать в виде:
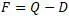
Из последнего уравнения видно, что F определяется разностью теплот (или энергий в форме теплоты).
Таким образом, уравнение Гельмгольца не выводится из уравнения Клазиуса, но уравнения могут быть связаны между собой при W = 0.
__
Гиббс назвал энергию Гельмгольца силовой функцией системы. Анализируя формулировку Гиббса, можно установить, что необходимо указать на различие между работами в формуле Клазиуса W и J и работой, получаемой от энергии F. В формулировку Гиббса должна входить работа, не используемая в формулировке Клазиуса.
Энергия Гиббса
Для энергии Гиббса также применяется термин свободной энтальпии.
При постоянном давлении процесса, изменение объема системы происходит за счет энергии от свободной энтальпии. То есть работа по изменению объема выполняется за счет разницы между теплосодержанием и количеством теплоты Q.
Уравнение энергии Гиббса:
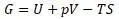
Уравнение связывает между собой функции энтальпии и энтропии системы. По структуре уравнения видно, что энергия Гиббса представляет разность между работой против внешних сил (энтальпийный член) и потерей на увеличение энтропии.
Рассмотрим уравнение Клазиуса
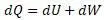
Уравнение энтальпии по структуре соответсвует этому уравнению и оно получается заменой выражений в этом уравнении, то есть:
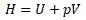
Но уравнение энергии Гиббса состоит из 4 слагаемых.
Перепишем уравнение Клазиуса:
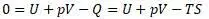
Так получена структура уравнения энергии Гиббса, обозначенная «G» c введением четвертого слагаемого. И эта функция не равна нулю в общем случае.
Такая структура показывает сильное отличие от структуры уравнения Гельмгольца при W=0.
В формуле энергии Гиббса и уравнении Клазиуса энергия «U» обозначает одинаковую физическую величину. При том, что для случая уравнения Гельмгольца и Клазиуса имеется несоответствие (см. соотв. параграф).
Сравним структуры формул Гиббса и Гельмгольца:
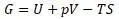
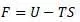
По виду уравнений, отличие состоит на первый взгляд в слагаемом «pV».
Однако, в уравнении Гельмгольца энтропийный член соответствует связанной энергии D из соображения Гельмгольца по делению энергии на связанную и свободную. А в уравнении Гиббса энтропийный член соответствует величине Q из уравнения Клазиуса. И как было показано выше, эти две величины отличаются на величину:
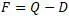
То есть, можно сделать вывод, что уравнения Гиббса и Гельмгольца имеют отличия в слагаемом TS, в величине энтропийного члена. Вместе с тем из сравнения структур этого нельзя сразу установить. Потребуется прочитать параграф, касающийся энергии Гельмгольца.
Уравнения для сравнительного прочтения можно представить в форме:
В записи в такой форме видна разница между физическим смыслом энергий «U» и энергий в тепловой связанной форме «Q» и «D».
Читать дальшеИнтервал:
Закладка: