А. Березовчук - Физическая химия: конспект лекций
- Название:Физическая химия: конспект лекций
- Автор:
- Жанр:
- Издательство:Конспекты, шпаргалки, учебники «ЭКСМО»b4455b31-6e46-102c-b0cc-edc40df1930e
- Год:2009
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
А. Березовчук - Физическая химия: конспект лекций краткое содержание
Данное учебное пособие предназначено для студентов химических факультетов высших учебных заведений педагогического и технического направления. Изложены основные концепции и процессы, составляющие современную физическую химию. Материал соответствует государственному стандарту. Пособие рекомендовано в помощь студентам при подготовке к экзаменам.
Физическая химия: конспект лекций - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Хронопотенциометрия в некоторых расплавах. Особенность – постоянная скорость подачи титранта в анализируемый расплав и непрерывная запись показателей рН-метра в процессе титрования. О количестве вещества судят по соответствующей длине диаграммной ленты самописца.
Применение хронопотенциометрии для физико-химического исследования расплавов
Определение коэффициента диффузии в расплавах:
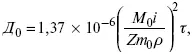
где m 0– концентрация ионов % масс;
М 0– молекулярная масса, г/моль;
ρ– плотность электролита, г/см 3.
Определение толщины диффузного слоя
В условиях принудительного перемешивания у поверхности электрода существует ограниченный диффузный слой. Для определения толщины используется уравнение хронопотенциограммы:
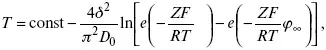
где φ ∞ – величина установившегося потенциала при заданном токе. По наклону прямой, выражающей зависимость (1), находят величину 4 δ 2/π 2D 0. Отношение D 0 / δопределяют из значения установившегося потенциала
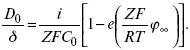
По величинам 4 δ 2/π 2D 0 и D 0 / δлегко найти δи D 0.
Определение растворимости Н 2, Cl 2, O 2в расплаве. Электродные процессы в расплавах с участием Н 2, Cl 2, O 2привлекают внимание исследователей в связи с развитием электрохимии топливных элементов. Растворимость газообразных веществ в расплавах находят по уравнению Сэнда. Величина произведения i x τ 1/2однозначно связана с величиной растворимости Н 2, Cl 2, O 2в расплаве, если между газами и компонентами расплава отсутствует какое-либо химическое взаимодействие. В двойной эвтектике CuCN и Cd(CN) 2растворимость Н 2подчиняется закону Генри. Для оценки абсолютного значения растворимости газов необходимо знать величину коэффициента диффузии. Если в исходном расплаве содержатся ионы О 2-, то между i x τ 1/2и концентрацией ионов О 2-наблюдается линейная зависимость, на основании которой можно судить о содержании О 2-.
ЛЕКЦИЯ № 9. Термохимия
1. Понятие термохимии
Раздел физической химии и химической термодинамики, изучающий тепловые процессы теплоемкости веществ, называется термохимией.
δ Q = dU + δ A – первый закон термодинамики. δ Q – не является функцией состояния. P = const || V = const – функции состояния при этих условиях. δ Q P= dH || δ Q V= dU вн – функции состояния при этих условиях.
2. Закон Гесса
При изобарных и изохорных условиях теплота является функцией состояния.
В 1840 г. Г. Н. Гесс формулирует закон: «Тепловой эффект химической реакции не зависит от промежуточных стадий, а зависит только от начального и конечного состояния системы».
δ Q P= dH,
δ Q V= dU вн,
Q P= Δ H,
Q V= Δ U вн.
Современная формулировка закона Гесса– общие приращения энтальпии при переходе начальных веществ в продукты реакции не зависят от того, через какие промежуточные стадии прошла реакция.
Закон Гесса позволяет рассчитать тепловые эффекты или приращение энтальпии только при стандартных условиях ( р = 1 атм = 10 5Па, Т = 273 К + 25 = 298 К).
Теплоты при стандартных условиях сведены в таблицу (справочник под редакцией Нищенко). Для индивидуальных веществ: С, Н 2, Fe и др. – Δ Н = 0.
Следствия из закона Гесса:
1) энтальпия образования 1 моля соединения из простых веществ не зависит от способа получения;
2) теплоты сгорания – «теплота реакции равна сумме теплот сгорания исходящих веществ за вычетом теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов»
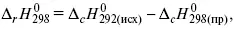
где r – реакции;
c – композиция;
3) теплоты образования – «тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения (продукт реакции), и теплотами образования всех веществ, указанных в левой части уравнения».
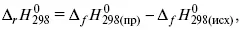
где f – формация.
Пример 1.Рассчитать тепловой эффект реакции этерификации спирта.
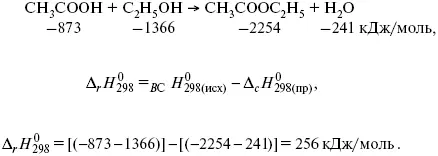
Пример 2.Рассчитать тепловой эффект реакции, протекающей по уравнению:
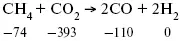
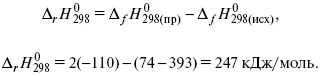
3. Закон Кирхгоффа. Интегральная форма уравнений Кирхгоффа
3акон Кирхгоффа
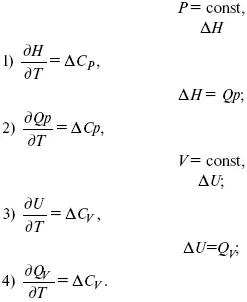
Это уравнения Кирхгоффа в дифференциальной форме.
Когда идет изменение функции по t – температурный коэффициент:
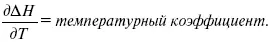
Закон Кирхгоффа:температурный коэффициент теплового эффекта равен изменению теплоемкости данного процесса.
Интегральная форма уравнений Кирхгоффа:
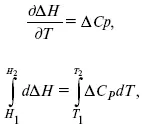
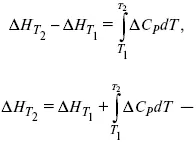
интегральная форма уравнений Кирхгоффа, Т 1 = 298 К.
1) Δ СР ≠ f(T)
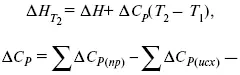
усредненное Δ Н при Т 1 – по закону Гесса;
2) Δ СР = f(T)
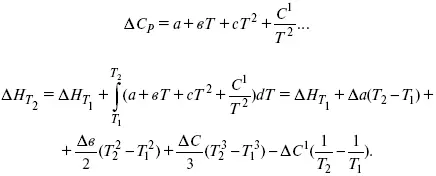
Пример 3.Рассчитать тепловой эффект химической реакции при Т= 1000 К (реакция сгорания С 2Н 5ОН).
С 2Н 5ОН + 30 2= 2С0 2+ ЗН 20 (самостоятельно).
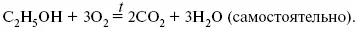
Все реакции – как реакции образования:
Т = 1000 к.
ЛЕКЦИЯ № 10. Гальванические элементы
1. Понятие гальванического элемента
Гальванический элемент– прибор, который преобразовывает химическую энергию в электрическую. Одним из таких элементов является элемент Даниэля – Якоби. Этот элемент состоит из двух электродов: цинкового и медного, – погруженных в соответствующие сульфатные растворы, между которыми пористая перегородка:
Читать дальшеИнтервал:
Закладка:










