Александр Китайгородский - Физика для всех. Движение. Теплота
- Название:Физика для всех. Движение. Теплота
- Автор:
- Жанр:
- Издательство:Наука
- Год:1974
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Китайгородский - Физика для всех. Движение. Теплота краткое содержание
Авторы этой книги – лауреат Ленинской и Нобелевской премий академик Л.Д. Ландау и профессор А.И. Китайгородский – в доступной форме излагают начала общего курса физики.
Примечательно, что вопросы атомного строения вещества, теория лунных приливов, теория ударных волн, теория жидкого гелия и другие подобные вопросы изложены вместе с классическими разделами механики и теплоты. Подобная тесная связь актуальных проблем физики с ее классическими понятиями, их взаимная обусловленность и неизбежные противоречия, выводящие за рамки классических понятий, – все это составляет сущность современного подхода к изучению физики.
Новое, свежее изложение делает книгу полезной для самого широкого круга читателей.
Физика для всех. Движение. Теплота - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Большой доклад Гельмгольца заключал в себе не только формулировку общих идей. Гельмгольц подробно рассмотрел все физические явления – тепловые, химические, электромагнитные, показал универсальность принципа эквивалентности и дал правила вычисления энергии.
После работы Гельмгольца на долю других физиков осталась лишь проверка и приложение принципа сохранения энергии. Успех всех этих исследований привел к тому, что к концу пятидесятых годов закон сохранения энергии был уже общепризнан как фундаментальный закон естествознания.
Уже в XX веке наблюдались явления, ставившие под сомнение закон сохранения энергии. Однако в дальнейшем видимые расхождения нашли свое объяснение. Закон сохранения энергии до сих пор всегда с честью выходил из испытаний.

ГЕРМАН ГЕЛЬМГОЛЬЦ (1821–1894) – знаменитый немецкий ученый. Гельмгольц с большим успехом работал в области физики, математики и физиологии. Он впервые (1847 г.) дал математическую трактовку закона сохранения энергии, подчеркнув всеобщий характер этого закона. Выдающиеся результаты принадлежат Гельмголъцу в термодинамике; он впервые применил ее к изучению химических процессов. Своими работами по вихревому движению жидкостей Гельмголъц заложил основы гидродинамики и аэродинамики. Ряд ценных исследований проведен им в области акустики и электромагнетизма. Гельмгольц развил физическую теорию музыки. В своих физических исследованиях применял мощные и оригинальные математические методы.
X. Строение вещества
Молекулы
Молекулы состоят из атомов. Атомы связаны в молекулы силами, которые называют химическими силами.
Существуют молекулы, состоящие из двух, трех, четырех атомов. Крупнейшие молекулы – молекулы белков – состоят из десятков и даже сотен тысяч атомов.
Царство молекул исключительно разнообразно. Уже сейчас химики выделили из природных веществ и создали в лабораториях миллионы веществ, построенных из разных молекул.
Свойства молекул определяются не только тем, сколько атомов того или иного сорта участвует в их постройке, но и тем, в каком порядке и в какой конфигурации они соединены. Молекула – это не груда кирпичей, а сложная архитектурная постройка, где каждый кирпич имеет свое место и своих вполне определенных соседей. Атомная постройка, образующая молекулу, может быть в большей или меньшей степени жесткой. Во всяком случае, каждый из атомов совершает колебание около своего положения равновесия. В некоторых же случаях одни части молекулы могут вращаться по отношению к другим частям, придавая свободной молекуле в процессе ее теплового движения различные и самые причудливые конфигурации.
Разберем подробнее взаимодействие атомов. На рис. 86 изображена кривая потенциальной энергии двухатомной молекулы. Она имеет характерный вид – сначала идет вниз, затем загибается, образуя «яму», и потом более медленно приближается к горизонтальной оси, по которой отложено расстояние между атомами.
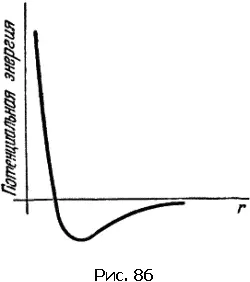
Мы знаем, что устойчиво состояние, в котором потенциальная энергия имеет наименьшее значение. Когда атом входит в состав молекулы, он «сидит» в потенциальной яме, совершая небольшие тепловые колебания около положения равновесия.
Расстояние от вертикальной оси до дна ямы можно назвать равновесным. На этом расстоянии расположились бы атомы, если бы прекратилось тепловое движение.
Кривая потенциальной энергии рассказывает о всех деталях взаимодействия между атомами. Притягиваются или отталкиваются частицы на том или ином расстоянии, возрастает или убывает сила взаимодействия при отдалении или сближении частиц – все эти сведения можно получить из анализа кривой потенциальной энергии. Точки левее «дна» соответствуют отталкиванию. Напротив, участки кривой правее дна ямы характеризуют притяжение.
Важные сведения сообщает и крутизна кривой: чем круче идет кривая, тем больше сила.
Находясь на больших расстояниях, атомы притягиваются один к другому; эта сила весьма быстро уменьшается с увеличением расстояния между ними. При сближении сила притяжения возрастает и достигает наибольшего значения уже тогда, когда атомы подойдут один к другому очень близко. При еще большем сближении притяжение ослабевает и, наконец, на равновесном расстоянии сила взаимодействия обращается в нуль. При сближении атомов на расстояние, меньшее равновесного, возникают силы отталкивания, которые очень резко нарастают и быстро делают практически невозможным дальнейшее уменьшение расстояния.
Равновесные расстояния (ниже мы будем говорить короче – расстояния) между атомами различны для разных сортов атомов.
Для разных пар атомов различны не только расстояния от вертикальной оси до дна ямы, но и глубина ям.
Глубина ямы имеет простой смысл – чтобы выкатиться из ямы, нужна энергия, как раз равная глубине. Поэтому глубину ямы можно назвать энергией связи частиц.
Расстояния между атомами молекул столь малы, что для их измерения надо выбрать подходящие единицы, иначе пришлось бы выражать их значения, например, в таком виде: 0,000000012 см. Это цифра для молекулы кислорода.
Единицы, особенно удобные для описания атомного мира, называются ангстремами (правда, фамилия шведского ученого, именем которого названы эти единицы, правильно читается Онгстрем; для напоминания об этом над буквой А ставят кружок).
1 Å = 10 −8см,
т.е. одной стомиллионной доле сантиметра.
Расстояния между атомами молекул лежат в пределах от 1 до 4 ангстрем. Написанное выше равновесное расстояние для кислорода равно 1,2 Å.
Межатомные расстояния, как вы видите, очень малы. Если опоясать земной шар веревкой у экватора, то длина «пояса» во столько же раз будет больше ширины вашей ладони, во сколько раз ширина ладони больше расстояния между атомами молекулы.
Для измерения энергии связи пользуются обычно калориями, но относят их не к одной молекуле, что дало бы, разумеется, ничтожную цифру, а к грамм-молекуле, т.е. к числу граммов, равному относительному молекулярному весу.
Ясно, что энергия связи на грамм-молекулу, если ее поделить на число Авогадро N = 6,023·10 23, даст энергию связи одной молекулы.
Энергия связи атомов в молекуле, как и межатомные расстояния, колеблется в незначительных пределах.
Для того же кислорода энергия связи равна 116 000 калорий на грамм-молекулу, для водорода – 103 000 калорий и т.д.
Читать дальшеИнтервал:
Закладка:







