Александр Китайгородский - Физика для всех. Движение. Теплота
- Название:Физика для всех. Движение. Теплота
- Автор:
- Жанр:
- Издательство:Наука
- Год:1974
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Китайгородский - Физика для всех. Движение. Теплота краткое содержание
Авторы этой книги – лауреат Ленинской и Нобелевской премий академик Л.Д. Ландау и профессор А.И. Китайгородский – в доступной форме излагают начала общего курса физики.
Примечательно, что вопросы атомного строения вещества, теория лунных приливов, теория ударных волн, теория жидкого гелия и другие подобные вопросы изложены вместе с классическими разделами механики и теплоты. Подобная тесная связь актуальных проблем физики с ее классическими понятиями, их взаимная обусловленность и неизбежные противоречия, выводящие за рамки классических понятий, – все это составляет сущность современного подхода к изучению физики.
Новое, свежее изложение делает книгу полезной для самого широкого круга читателей.
Физика для всех. Движение. Теплота - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Мы уже говорили, что атомы в молекулах располагаются вполне определенным образом одни по отношению к другим, образуя в сложных случаях весьма замысловатые постройки.
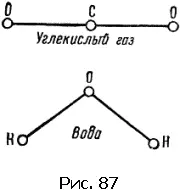
Приведем несколько простых примеров. В молекуле СO 2(углекислый газ) все три атома расположены в ряд – атом углерода посередине. Молекула воды Н 2O имеет уголковую форму, вершиной угла (он равен 105°) является атом кислорода.
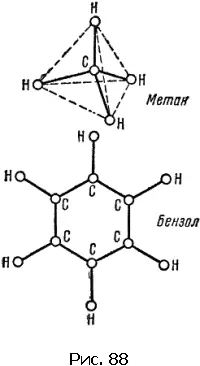
В молекуле аммиака NH 3атом азота находится в вершине трехгранной пирамиды; в молекуле метана СН 4атом углерода находится в центре четырехгранной фигуры с равными сторонами, которая называется тетраэдром.
Атомы углерода бензола С 6Н 6образуют правильный шестиугольник. Связи атомов углерода с водородом идут от всех вершин шестиугольника. Все атомы расположены в одной плоскости.
Схемы расположения центров атомов этих молекул показаны на рис. 87 и 88. Линии символизируют связи.
Прошла химическая реакция; были молекулы одного сорта, образовались другие. Одни связи порваны; другие созданы вновь. Для разрыва связей между атомами – вспомните рисунок – нужно затратить такую же работу, как при выкатывании шара из ямы. Напротив, при образовании новых связей энергия выделяется – шар скатывается в яму.
Что больше, работа разрыва или работа созидания? В природе мы сталкиваемся с реакциями обоих типов.
Излишек энергии называется тепловым эффектом, или короче – теплотой превращения (реакции). Тепловые эффекты реакций – это большей частью величины порядка десятков тысяч калорий при расчете на моль. Очень часто тепловой эффект включают в качестве слагаемого в формулу реакции.
Например, реакция сгорания углерода в виде графита, т.е. соединения его с кислородом, пишется так:
С + О 2= СO 2+ 94 250 кал.
Это значит, что при соединении С с O 2выделяется энергия 94 250 калорий.
Сумма внутренних энергий грамм-атома углерода в графите и грамм-молекулы кислорода равняется внутренней энергии грамм-молекулы углекислого газа плюс 94 250 калорий.
Таким образом, подобные записи имеют ясный смысл алгебраических равенств, записанных для величин внутренней энергии.
С помощью таких уравнений можно найти тепловые эффекты превращений, для которых не годятся по тем или иным причинам прямые способы измерения. Вот пример: если бы углерод (графит) соединить с водородом, то образовался бы газ ацетилен:
2С + Н 2= С 2Н 2.
Реакция не идет таким путем. Тем не менее можно найти ее тепловой эффект. Запишем три известные реакции –
окисление углерода:
2С + 2О 2= 2СО 2+ 188 000,
окисление водорода:
Н 2+ (1/2)О 2= Н 2О + 68 000,
окисление ацетилена:
С 2Н 2+ (5/2)O 2= 2СО 2+ Н 2О + 312 000.
Все эти равенства можно рассматривать как уравнения для энергий связи молекул. Если так, то ими можно оперировать как с алгебраическими равенствами. Вычитая из нижнего два верхних, получим:
2С + H 2= С 2Н 2− 56 000.
Значит, интересующее нас превращение сопровождается поглощением 56 000 калорий на одну грамм-молекулу.
Взаимодействие молекул
Молекулы взаимно притягиваются, в этом невозможно сомневаться. Если бы в какое-то мгновение молекулы перестали притягиваться друг к другу, все жидкие и твердые тела распались бы на молекулы.
Молекулы взаимно отталкиваются, и это несомненно, так как иначе жидкости и твердые тела сжимались бы с необыкновенной легкостью.
Между молекулами действуют силы, во многом похожие на силы между атомами, о которых говорилось выше. Кривая потенциальной энергии, которую мы только что рисовали для атомов, правильно передает основные черты взаимодействия молекул. Однако между этими взаимодействиями имеются и существенные различия.
Сравним, например, равновесное расстояние между атомами кислорода, образующими молекулу, и атомами кислорода двух соседних молекул, притянувшихся в затвердевшем кислороде до равновесного положения. Различие будет очень заметным: атомы кислорода, образующие молекулу, устанавливаются на расстоянии 1,2 Å, атомы кислорода разных молекул подходят друг к другу на 2,9 Å.
Подобные результаты получаются и для других атомов. Атомы чужих молекул устанавливаются дальше один от другого, чем атомы одной молекулы. Поэтому молекулы легче оторвать одну от другой, чем атомы от молекулы, причем различия в энергиях много больше разницы в расстояниях. Если энергия, необходимая для разрыва связи между атомами кислорода, образующими молекулу, составляет около 100 ккал/моль, то энергия на растаскивание молекул кислорода меньше 2 ккал/моль.
Значит, на кривой потенциальной энергии молекул «яма» лежит дальше от вертикальной оси и, кроме того, «яма» гораздо менее глубока.
Однако этим не исчерпывается различие взаимодействия атомов, образующих молекулу, и взаимодействия молекул.
Химики показали, что атомы сцепляются в молекулу с вполне определенным числом других атомов. Если два атома водорода образовали молекулу, то третий атом уже не присоединится к ним для этой цели. Атом кислорода в воде соединен с двумя атомами водорода и присоединить к ним еще один невозможно.
Ничего подобного мы не находим в межмолекулярном взаимодействии. Притянув к себе одного соседа, молекула ни в какой степени не теряет своей «притягательной силы». Подход соседей будет происходить до тех пор, пока хватит места.
Что значит «хватит места»? Разве молекулы – это что-то вроде яблок или яиц? Конечно, в некотором смысле такое сравнение оправдано: молекулы – физические тела, обладающие определенными «размерами» и «формой». Равновесное расстояние между молекулами и есть не что иное, как «размеры» молекул.
Как выглядит тепловое движение
Взаимодействие между молекулами может иметь большее или меньшее значение в «жизни» молекул.
Три состояния вещества – газообразное, жидкое и твердое – различаются одно от другого той ролью, которую в них играет взаимодействие молекул.
Слово «газ» придумано учеными. Оно произведено от греческого слова «хаос» – беспорядок.
И действительно, газообразное состояние вещества является примером существующего в природе полного, совершенного беспорядка во взаимном расположении и движении частиц. Нет такого микроскопа, который позволил бы увидеть движение газовых молекул, но, несмотря на это, физики могут достаточно детально описать жизнь этого невидимого мира.
В кубическом сантиметре воздуха при нормальных условиях (комнатная температура и атмосферное давление) находится огромное число молекул, примерно 2,5·10 19(т.е. 25 миллиардов миллиардов молекул). На каждую молекулу приходится объем 4·10 −20см 3, т.е. кубик со стороной примерно 3,5·10 −7см = 35 Å. Однако молекулы очень малы. Например, молекулы кислорода и азота – основная часть воздуха – имеют средний размер около 4 Å.
Читать дальшеИнтервал:
Закладка:







