Enrique Alvarez - Масса атомов. Дальтон. Атомная теория
- Название:Масса атомов. Дальтон. Атомная теория
- Автор:
- Жанр:
- Издательство:Де Агостини
- Год:2014
- Город:М.
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Enrique Alvarez - Масса атомов. Дальтон. Атомная теория краткое содержание
Джон Дальтон является основоположником атомной теории и одним из создателей современной химии. Преподаватель скромной начальной школы Манчестера обратился к идеям, сформулированным за тысячу лет до него Демокритом и другими греческими философами, и предположил, что весь мир состоит из неделимых атомов и в результате их взаимодействия появляются элементы, которые, в свою очередь, образуют химические соединения. Несмотря на то что существование атомов вызывало серьезные споры вплоть до начала XX века — то есть и через 100 лет после публикации труда Дальтона, — именно работа этого просветителя, не получившего университетского образования, легла в основу концептуальной революции, изменившей лицо науки.
Масса атомов. Дальтон. Атомная теория - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Чтобы покончить с путаницей, в 1908 году Резерфорд отделил альфа-частицы, поместив радиоактивный материал в стеклянную трубку, в которой находилась другая, более тонкая трубка. Первый барьер преодолевали только альфа-частицы. Отделив их, он выяснил их электрический заряд. Так появились спектральные линии гелия. Резерфорд знал, что один из загадочных видов радиоактивности образован положительными частицами гелия (второго элемента периодической таблицы), испускаемыми из его атомного ядра.
В том же 1908 году Резерфорд получил Нобелевскую премию по химии, однако остался неудовлетворен — не самой премией, а областью, в которой она была вручена. Самый важный свой опыт ученый провел между 1910 и 1911 годами. Вместе со своим немецким ассистентом Гансом Гейгером, более известным как изобретатель счетчика радиоактивных частиц, он пропустил ионизированные атомы гелия — альфа-частицы — через лист золотой фольги. К огромному удивлению исследователей — и к удивлению всего человечества, — некоторые частицы отскакивали обратно: можно сказать, что ученые обстреливали тонкий лист бумаги, но сквозь него проходили далеко не все пули. Вывод: атом практически пуст, но в центре него содержится очень плотное ядро.
Историки приписывают Резерфорду также открытие в 1918 году протона ("первый") — позитивно заряженной субатомной частицы. Хотя, наверное, следовало бы присвоить славу ее открытия (хотя бы частично) немецкому физику Ойгену Гольдштейну (1850-1930). В 1886 году Гольдштейн осуществил похожий на эксперимент Томсона опыт с перфорированным катодом и выделил частицу, масса которой была сходна с массой атома водорода, но позитивно заряженную. Он принял эту частицу за простой ион.
Резерфорд повторил опыт, бомбардируя атомы азота альфа-частицами, и обнаружил сверкание, которое мог производить только азот. Эта реакция стала первым превращением, осуществленным искусственно, в отличие от естественной радиации. Мы можем представить ее сегодня как физическую реакцию со следующей формулой:
4He + 14N → 17O + 1Н,
в которой величины соответствуют атомной массе. Слева направо ядро гелия (2 протона и 2 нейтрона) взаимодействует с ядром водорода (7 протонов и 7 нейтронов), и образуются ядро кислорода-17 (изотоп с 8 протонами, но 9 нейтронами) и ядро водорода (1 протон). Наверное, это была первая алхимическая реакция в истории.
Модель атома Резерфорда (см. рисунок на странице 134) с электронами на периферии и протонами, содержащимися в плотном ядре, превратилась для физиков в неразрешимую проблему.
Протон был выделен в 1920 году Эрнестом Резерфордом во время изучения ядер гелия, раньше называвшихся альфа-частицами и излучаемых при естественной радиоактивности. На самом деле Резерфорд выделил ядро водорода, самый распространенный в природе изотоп которого состоит из одного протона. Во время этого опыта Резерфорд осуществил первую в истории атомную реакцию, превратив атомы азота в кислород. В продукте реакции Резерфорд выделил ядро водорода и предположил, как и задолго до него английский химик Уильям Прут (1785-1850), что водород может быть основным элементом, или частицей, образующей другие атомы. Даже если на самом деле это не совсем так, факт заключается в том, что Резерфорд предложил называть его протоном по двум причинам: во-первых, он заимствовал греческое слово, означающее "первый", во-вторых, это название напоминало о фамилии Прута.
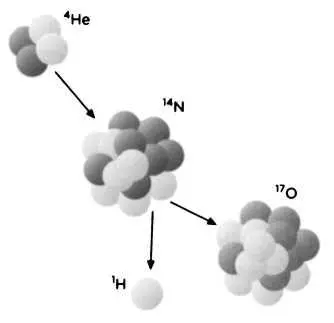
Перво· атомное превращение в истории заключалось в превращении атома азота в кислород в следующей реакции:
4He + 14N → 17O + 1Н.
Она противоречила законам электромагнетизма, описанным Джеймсом Клерком Максвеллом, хотя эти законы были доказаны многочисленными опытами. По Максвеллу, электрический заряд в движении — в нашем случае электрон — должен постоянно излучать энергию. И со временем из-за потери этой энергии он должен упасть на ядро, и тогда атом коллапсирует. Кроме того, протоны с одинаковым положительным зарядом должны отталкиваться друг от друга, а не оставаться в маленьком пространстве в центре атома.
Появилась главная проблема: микроскопический мир вел себя не так, как макроскопический. Резерфорд долгие годы размышлял над этим вопросом и в итоге пришел к гипотезе, что положительный заряд протона должен быть компенсирован, или, скорее, нейтрализован, другими частицами. Когда мы описывали получение протона из азота, мы уже использовали понятие нейтрона.
Один из учеников Резерфорда, английский физик Джеймс Чедвик, попытался найти нейтроны, и это ему удалось сделать в 1932 году, после 11 лет исследований. В результате нейтрон стал главным инструментом при ядерном делении, или распаде, поскольку он лишен электрического заряда, следовательно никак себя не проявляет, пока не проникнет в атомы более тяжелых элементов. Лауреат Нобелевской премии по физике 1935 года Чедвик против своей воли проложил дорогу к атомной бомбе.
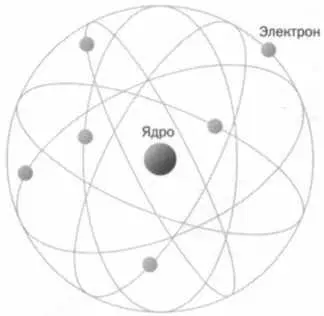
Схема модели Резерфорда (1911).
Список рекомендуемой литературы
Asimov, I., Introduction a la tientia, Barcelona, Ediciones Orbis, 1985.
—: Breve historia de la qutmica, Madrid, Alianza Editorial, 2006.
Bryson, B., Una breve historia de cast todo, Barcelona, RBA, 2003.
Gamow, G., Biografta de la ftsica, Madrid, Alianza Editorial, 2007.
Gribbin, J., Historia de la tientia, 1543-2001, Barcelona, Critica, 2003.
Pellôn, I., Dalton, el hombre que peso los dtomos, Madrid, Nivola, 2003.
Lit & Phil 11, 26-29, 31, 34, 43, 53, 54, 57, 72, 78, 80, 97, 99-101, 126
Лвогадро, Амедео 36, 37, 75, 89, 95, 106, 109, 110, 116, 119-121, 126
закон Лвогадро 110, 116
число Лвогадро 95, 119-121
алхимия 69, 83, 85, 86, 90, 115, 128
анод 100, 101, 128
Аристотель 68, 69
атом 7-10, 13, 16, 19-26, 28-34, 36-37, 60, 62, 65, 67, 68, 71-76, 81, 83, 86-88, 90, 91, 93-97, 101, 103-110, 112, 116-118, 120-124, 126, 127, 129-139, 141, 142
атомизм 7-9, 30, 67, 68, 86-88, 91, 94, 105, 112, 117, 120
атомная масса 37, 74, 93-95, 97, 104, 112, 116, 124, 132, 134, 136, 137
единица атомной массы 94, 95
относительная 9, 29, 116, 123, 137
атомый номер 94, 130, 136
Беккерель, Анри 125-127, 131
Бертолле, Клод Луи 11, 78, 91-92, 97, 102, 105, 111
Берцелиус, Йенс Якоб 106-109
правило кислоты Берцелиуса 107
химическая формула Берцелиуса 108, 112, 116
Бехер, Иоганн 85, 86
Блэк, Джозеф 52, 86 бозон 145
Бойль, Роберт 56, 69-70, 83, 85-92, 103, 115, 119
закон Бойля 89, 90, 103
Больцман, Людвиг 20, 36-37, 89, 117-120
постоянная Больцмана 37, 89, 119, 120
Бор, Нильс 32, 37, 126, 137-139
атомная модель Бора 138, 139
ботаник 23, 47, 48, 49
Браге, Тихо 22
Британская ассоциация содействия прогрессу науки 99
Брольи, Луи-Виктор де 138
Броун, Роберт 21, 120
броуновское движение 10, 21, 36, 110, 120-122
Читать дальшеИнтервал:
Закладка: