Ричард Фейнман - 1. Современная наука о природе, законы механики

- Название:1. Современная наука о природе, законы механики
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Ваша оценка:
Ричард Фейнман - 1. Современная наука о природе, законы механики краткое содержание
1. Современная наука о природе, законы механики - читать онлайн бесплатно полную версию (весь текст целиком)
Шрифт:
Интервал:
Закладка:
Вы понимаете, конечно, что на самом деле все происходит гораздо сложнее, чем здесь описано. Не только вода переходит в воздух, но молекулы кислорода или азота время от времени переходят в воду и «теряются» в массе молекул воды. Попадание атомов кислорода и азота в воду означает растворение воздуха в воде; если внезапно из сосуда воздух выкачать, то молекулы воздуха начнут из воды выделяться быстрее, чем проникают в нее; мы увидим, как наверх подымаются пузырьки. Вы, наверно, слыхали, что это явление очень вредно для ныряльщиков.
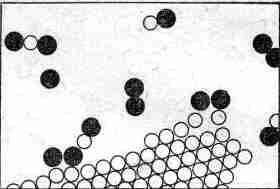
Перейдем теперь к другому процессу. На фиг. 1.6 мы видим, как (с атомной точки зрения) соль растворяется в воде.

Фиг. 1.6 . Молекулы соли, растворяющейся в воде.
Что получается, если в воду бросить кристаллик соли? Соль — твердое тело, кристалл, в котором «атомы соли» расставлены правильными рядами. На фиг. 1.7 показано трехмерное строение обычной соли (хлористого натрия).
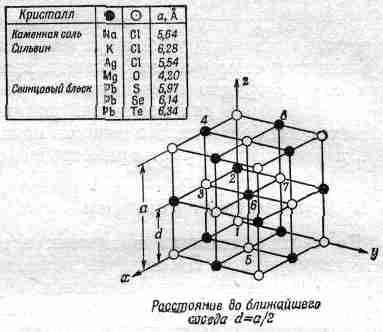
Фиг. 1.7. Структура кристалла соли.
Строго говоря, кристалл состоит не из атомов, а из ионов. Ионы — это атомы с излишком или с нехваткой электронов. В кристалле соли мы находим ионы хлора (атомы хлора с лишним электроном) и ионы натрия (атомы натрия, лишенные одного электрона). Ионы в твердой соли скреплены друг с другом электрическим притяжением, но в воде некоторые из них, притянувшись к положительному водороду или отрицательному кислороду, начинают свободно двигаться. На фиг. 1.6 виден освободившийся ион хлора и другие атомы, плавающие в воде в виде ионов. На рисунке нарочно подчеркнуты некоторые детали процесса. Заметьте, например, что водородные концы молекул воды обычно обступают ион хлора, а возле иона натрия чаще оказывается кислород (ион натрия положителен, а атом кислорода в молекуле воды отрицателен, поэтому они притягиваются). Можно ли из рисунка понять, растворяется ли здесь соль в воде или же выкристаллизовывается из воды? Ясно, что нельзя; часть атомов уходит из кристалла, часть присоединяется к нему. Процесс этот динамический, подобный испарению; все зависит от того, много или мало соли в воде, в какую сторону нарушено равновесие. Под равновесным понимается такое состояние, когда количество уходящих атомов равно количеству приходящих. Если в воде почти нет соли, то больше атомов уходит в воду, чем возвращается из воды: соль растворяется. Если же «атомов соли» слишком много, то приход превышает уход, и соль выпадает в кристаллы. Мы мимоходом упомянули, что понятие молекулы вещества не совсем точно и имеет смысл только для некоторых видов веществ. Оно применимо к воде, в ней действительно три атома всегда скреплены между собой, но оно не очень подходит к твердому хлористому натрию. Хлористый натрий — это ионы хлора и натрия, образующие кубическую структуру. Нельзя естественным путем сгруппировать их в «молекулы соли».
Вернемся к вопросу о растворении и осаждении соли. Если повысить температуру раствора соли, то возрастет и число растворяющихся атомов и число осаждаемых. Оказывается, что в общем случае трудно предсказать, в какую сторону сдвинется процесс, быстрей или медленней пойдет растворение. С ростом температуры большинство веществ начинает растворяться сильней, а у некоторых растворимость падает.
§ 4. Химические реакции
Во всех описанных процессах атомы и ионы не меняли своих напарников. Но, конечно, возможны обстоятельства, в которых сочетания атомов меняются, образуя новые молекулы. Это показано на фиг. 1.8.
Фиг. 1.8. Уголь, горящий в кислороде.
Процесс, в котором атомные партнеры меняются местами, называется химической реакцией. Описанные нами прежде процессы называются физическими, но трудно указать резкую границу между теми и другими. (Природе все равно, как мы это назовем, она просто делает свое дело.) На картинке мы хотели показать, как уголь горит в кислороде. Молекула кислорода состоит из двух атомов, сцепленных очень крепко. (А почему не из трех или даже не из четырех? Такова одна из характерных черт атомных процессов: атомы очень разборчивы, им нравятся определенные партнеры, определенные направления и т. д. Одна из обязанностей физики — разобраться, почему они хотят именно то, что хотят. Во всяком случае два атома кислорода, довольные и насыщенные, образуют молекулу.)
Предположим, что атомы углерода образуют твердый кристалл (графит или алмаз). Одна из молекул кислорода может пробраться к углероду, каждый ее атом подхватит по атому углерода и улетит в новом сочетании углерод — кислород. Такие молекулы образуют газ, называемый угарным. Его химическое имя СО. Что это значит? Буквы СО — это фактически картинка такой молекулы: С — углерод, О — кислород. Но углерод притягивает к себе кислород намного сильнее, чем кислород притягивает кислород или углерод — углерод. Поэтому кислород для этого процесса может поступать с малой энергией, но, схватываясь с неимоверной жадностью и страстью с углеродом, высвобождает энергию, поглощаемую всеми соседними атомами. Образуется большое количество энергии движения (кинетической энергии). Это, конечно, и есть горение; мы получаем тепло от сочетания кислорода и углерода. Теплота в обычных условиях проявляется в виде движения молекул нагретого газа, но иногда ее может быть так много, что она вызывает и свет. Так получается пламя.
Вдобавок молекулы СО могут не удовольствоваться достигнутым. У них есть возможность подсоединить еще один атом кислорода; возникает более сложная реакция: кислород в паре с углеродом столкнется с другой молекулой СО. Атом кислорода присоединится к СО и в конечном счете образуется молекула из одного углерода и двух кислородов. Ее обозначают С02 и называют углекислым газом. Когда углерод сжигают очень быстро (скажем, в моторе автомашины, где взрывы столь часты, что углекислота не успевает образоваться), то возникает много угарного газа. Во многих таких перестановках атомов выделяется огромное количество энергии, наблюдаются взрывы, вспыхивает пламя и т. д.; все зависит от реакции.
Химики изучили эти расположения атомов и установили, что любое вещество — это свой тип расположения атомов.
Чтобы объяснить эту мысль, рассмотрим новый пример. У клумбы фиалок вы сразу чувствуете их «запах». Это значит, что в ваш нос попали молекулы, или расположения атомов особого рода. Как они туда попали? Ну, это просто. Раз запах — это молекулы особого рода, то, двигаясь и сталкиваясь повсюду, они случайно могли попасть и в нос. Конечно, они не стремились попасть туда. Это просто беспомощные толпы молекул, и в своих бесцельных блужданиях эти осколки вещества, случается, оказываются и в носу.
Шрифт:
Интервал:
Закладка:




