Коллектив авторов - Молекулярная морфология. Методы флуоресцентной и конфокальной лазерной микроскопии
- Название:Молекулярная морфология. Методы флуоресцентной и конфокальной лазерной микроскопии
- Автор:
- Жанр:
- Издательство:Литагент СпецЛит
- Год:неизвестен
- ISBN:978-5-299-00642-1
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Коллектив авторов - Молекулярная морфология. Методы флуоресцентной и конфокальной лазерной микроскопии краткое содержание
Настоящее руководство может являться справочным пособием для специалистов, применяющих в своей работе флуоресцентные методы и конфокальную микроскопию, а также будет полезно для студентов биологических и медицинских факультетов, изучающих морфологические и нейробиологические дисциплины.
Молекулярная морфология. Методы флуоресцентной и конфокальной лазерной микроскопии - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
1.5.4. Фёрстеровская (флуоресцентная) резонансная передача энергии (Fӧrster (Fluorescence) Resonance Energy Transfer – FRET)
Фёрстеровская резонансная передача энергии, или иначе диполь-дипольный перенос энергии, – это механизм переноса энергии между двумя молекулами (от донора к акцептору), который происходит без промежуточного испускания фотонов и является результатом диполь-дипольного взаимодействия между донором, находящимся в возбужденном состоянии, и акцептором. Характерная черта данного процесса – тушение флуоресценции донора и возникновение более длинноволновой флуоресценции у акцептора, которая детектируется конфокальным микроскопом. При этом перенос возбуждения сопровождается уменьшением времени жизни и квантового выхода флуоресценции донора, для которого акцептор выступает в роли тушителя. Скорость переноса убывает как r –6, где r – расстояние между донором и акцептором, что используется для измерения расстояния между двумя молекулами или между двумя метками в одной молекуле. Для характеристики этого явления вводится понятие фестеровского радиуса ( R F ) – это эффективное расстояние, на котором скорость перехода составляет 50 % от максимума (для большинства систем его величина составляет 20 – 50 Å). Если расстояние между донором и акцептором превышает 10 нм, то диполь-дипольный перенос энергии не возможен. Помимо расстояния скорость переноса зависит от степени перекрывания спектров испускания донора и поглощения акцептора, от взаимной ориентации диполей донора и акцептора и от времени жизни возбужденного состояния донора в отсутствие акцептора. Константа скорости переноса энергии k et определяется выражением:
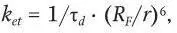
где τ d– время жизни возбужденного состояния донора в отсутствие акцептора.
Для реализации технологии FRET необходимо, чтобы:
1) донорный зонд обладал достаточным временем жизни для осуществления переноса энергии;
2) молекулы донора и акцептора располагались на расстоянии 1 – 10 нм друг от друга;
3) спектр поглощения флуорохрома акцептора накладывался на спектр испускания флуоресценции флуорохрома донора (примерно на 30 %);
4) для переноса энергии ориентации диполя донора и акцептора были примерно параллельны друг другу;
5) пары флуорохромов соответствовали имеющимся в конструкции микроскопа лазерам.
Наиболее часто используемые пары донор – акцептор приведены в обзоре, расположенном на сайте http://www.mdpi.com/ 1420-3049/17/4/4047р. 4088.
Существуют несколько методов исследований FRET: фотоотбеливание акцептора/донора; метод спектральной конфокальной микроскопии в применении к FRET; микроскопия для исследования времени жизни флуоресценции (fluorescence lifetime imaging microscopy – FLIM) и метод поляризации флуоресценции (Ishikawa-Ankerhold Н. С. [et al.], 2012). В зависимости от задачи данные модификации метода FRET позволяют следить за конформационными изменениями в белках, изучать кинетику ферментативных реакций, исследовать белок-белковые и другие взаимодействия. Например, по изменению FRET-сигнала между Gá иGâã субъединицами G-белка, слитыми с флуоресцирующими белками CFP и YFP, можно охарактеризовать динамические характеристики диссоциации G-белка в живых клетках; две субъединицы никотиновых ацетилхолиновых рецепторов á4 и â2, слитые с YFP и CFP, послужили основой для разработки клеточных систем, на основе которых с применением спектральной конфокальной микроскопии показана возможность измерять уровень á4â2-рецепторов и изучать процессы их сборки-диссоциации под воздействием различных стимулов. С помощью методики FLIM смогли в системе реального времени отслеживать уровень фосфорилированной формы эпидермального фактора роста (ЭФР), для чего к ЭФР пришили GFP, а к антителам, реагирующим с фосфоЭФР, – Cy3 (Grigsby C. L. [et al.], 2012; Zeug A. [et al.], 2012).
Литература
Голышевская В. И., Егорова О. В., Севастьянова Э. В., Шульгина М. В. Люминесцентная микроскопия: учебное пособие для проведения курсов обучения: «Культуральные методы диагностики туберкулеза», «Выявление туберкулеза методом микроскопии». – М.; Тверь: Триада, 2008. – 36 с.
Лукашева Н. Н., Ткаченко С. Б., Потекаев Н. Н., Кузьмина Т. С., Василевская Е. А. Прижизненная отражательная конфокальная лазерная сканирующая микроскопия: история создания, принцип работы, возможности применения в дерматологии // Клиническая дерматология и венерология. – 2008. – № 5. – С. 10 – 15.
Манцызов Б. И. Когерентная и нелинейная оптика. – М.: ФИЗМАТЛИТ, 2009. – 208 с.
Олейников В. А . Полупроводниковые флуоресцентные нанокристаллы (квантовые точки) в белковых биочипах // Биоорг. химия. – 2011. – 37 (2). – С. 171 – 189.
Сайфитдинова А. Ф. Двумерная флуоресцентная микроскопия для анализа биологических образцов: учебно-методическое пособие. – СПб.: СОЛО, 2008. – 72 с.
Соболев А. С. Как измеряют подвижность макромолекул в живых клетках // Соросовский образовательный журнал. – 2000. – Т. 6. – № 4. – С. 2 – 6.
Феофанов А. В. Спектральная лазерная сканирующая конфокальная микроскопия в биологических исследованиях // Успехи биологической химии. – 2007. – Т. 47. – С. 371 – 410.
Фейнман Р. Фейнмановские лекции по физике :в9 т. – 6-еизд. сущ. испр. – М.: УРСС: Издательский дом «ЛИБРОКОМ», 2011. – Т. 3: Излучение. Волны. Кванты. – 264 с.
Штейн Г. И. Руководство по конфокальной микроскопии. – СПб.: ИНЦ РАН, 2007. – 77 с.
Dailey M. E., Manders E., Soll D., Terasaki M. Chapter 19 Confocal Microscopy of Live Cells In «Handbook of Biological Confocal Microscopy, 3rd Ed.». – New York: Springer, 2006. – Р. 381 – 404.
Grigsby C. L., Ho Y. P., LeongK. W. Understanding nonviral nucleic acid delivery with quantum dot-FRET nanosensors // Nanomedicine (Lond). – 2012. – Vol. 7 (4). – P. 565 – 577.
Ishikawa-Ankerhold H. C., Ankerhold R., Drummen G. P. C. Advanced Fluorescence Microscopy Techniques – FRAP, FLIP, FLAP, FRET and FLIM // Molecules. – 2012. – Vol. 17. – Р. 4047 – 4132.
Nair B. J., Sivakumar T. T., Joseph A. P., Varun B. R., Mony V. Confocal microscopy // Health Sciences. – 2012. – 1(3): JS004A. – Р. 1 – 6.
Tsien R. Y., Ernst L., Waggoner A. Fluorophores for Confocal Microscopy: Photophysics and Photochemistry In «Handbook of Biological Confocal Microscopy, 3rd Ed.». – New York: Springer, 2006. – Р. 338 – 352.
Zeug A., Woehler A., Neher E., Ponimaskin E. G . Quantitative intensity-based FRET approaches – a comparative snapshot // Biophys. J. – 2012. – Vol. 103 (9). – Р. 1821 – 1827.
Глава 2.
ФЛУОРЕСЦЕНТНЫЕ КРАСИТЕЛИ И ДРУГИЕ ФЛУОРЕСЦИРУЮЩИЕ ВЕЩЕСТВА, ПРИМЕНЯЕМЫЕ В МОРФОЛОГИЧЕСКИХ ИССЛЕДОВАНИЯХ
В современных морфологических исследованиях, в случае использования флуоресцентной микроскопии и конфокальной лазерной микроскопии, для окрашивания препаратов применяют различные флуоресцентные красители. При проведении иммуноцитохимических исследований связанные с клеточными и тканевыми антигенами антитела выявляются благодаря включению флуоресцентной метки. Флуоресцирующие вещества, используемые в качестве флуоресцентной метки, присоединенной к нефлуоресцирующим молекулам (нуклеотидам, пептидам, антителам), а также флуоресцентные красители принято называть флуорохромами. Флуоресцентные красители и другие флуорохромы способны расходовать часть энергии поглощенного излучения на флуоресценцию (излучение определенной длины волны) при возвращении из возбужденного состояния в стабильное. Каждый флуорохром обладает индивидуальным спектром излучения и поглощения, наиболее интенсивная флуоресценция наблюдается при облучении красителя светом с длиной волны, близкой к характерному для него максимуму поглощения.
Читать дальшеИнтервал:
Закладка:










