Илья Леенсон - Занимательная химия для детей и взрослых
- Название:Занимательная химия для детей и взрослых
- Автор:
- Жанр:
- Издательство:Array Литагент «АСТ»
- Год:2010
- Город:Москва, Санкт-Петербург
- ISBN:978-5-98986-320-4, 978-5-271-25110-8
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Илья Леенсон - Занимательная химия для детей и взрослых краткое содержание
Занимательная химия для детей и взрослых - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Итак, автор принес канистру домой, надел купальный костюм и маску и, держа в одной руке канистру, а в другой – тяжелый гаечный ключ, прыгнул в свой бассейн. Находясь под водой, он безуспешно пытался отвернуть пробку. При этом, как он вспоминает, за ним наблюдали двое: жена – очень волнуясь, а собака – с искренним интересом.
Отвернуть пробку так и не удалось. Но оказалось, что пустого места в канистре достаточно, чтобы она плавала на воде, и тут же возникла новая идея. Сернистый газ замерзает при температуре ниже –75,5 °С. Почему бы не заморозить канистру (для этого можно использовать жидкий азот, температура которого равна –196 °С), продырявить ее и бросить в воду – тогда жидкий сернистый газ, нагреваясь и испаряясь, будет постепенно растворяться в воде бассейна. Чтобы снизить расход жидкого азота, Спаро поставил канистру в домашний морозильник, температура в котором была около –20 °С. (При этом опасения жены несколько изменили свою направленность – она стала волноваться уже за сохранность холодильника и продуктов в нем.)
На следующий день автор принес из университета сосуд Дьюара с двумя литрами жидкого азота. Этого количества оказалось достаточно, чтобы за 5 минут канистра охладилась значительно ниже, чем в морозильнике, а ее содержимое затвердело. Попросив жену отойти подальше (собака на эту просьбу не отреагировала) и сделав глубокий вдох, отважный химик, вооружившись большой отверткой, погрузил канистру в воду и пробил в ней дыру. Его мысли при этом вертелись вокруг вопроса, насколько обоснованны законы физической химии; оказывается, даже профессиональные ученые в определенных ситуациях могут в этом сомневаться… К счастью, законы сработали отменно: из отверстия не вышло ни миллиграмма замороженного ядовитого газа. Действительно, уже при температуре плавления (–75,5 °С) давление паров SO 2снижается в 80 раз по сравнению с атмосферным, а при –100 °С – в тысячу раз и составляет менее 1 мм рт. ст. Так что с понижением давления не ядовитый газ должен был выходить наружу, а наоборот – в пробитое отверстие должен был сразу зайти воздух (а в условиях «эксперимента» – вода). Удивительно другое: как канистра выдержала такое снижение давления в ней и не сплющилась в процессе охлаждения! Возможно, в ней, кроме жидкого SO 2и его паров, был также воздух.
Некоторое время холодная канистра не представляла опасности. Так что можно было спокойно привязать к ней кирпич и бросить в бассейн. Кирпич лег на дно, а канистра висела между дном и поверхностью воды. Вскоре ее содержимое достаточно разогрелось, давление паров SO 2превысило атмосферное (плюс небольшое давление столба воды), и из отверстия начали выделяться пузырьки газа. В чистой воде было видно, что, поднимаясь, они успевали растворяться, пройдя всего четверть метра, и потому не достигали поверхности. Через 10 минут весь сернистый газ оказался растворенным в воде; никаких следов его запаха в воздухе не чувствовалось, а на опущенном в воду рН-индикаторе надпись «Добавить кислоту» сменилась на «Нормально». Так химику удалось справиться с задачей, и при этом получить моральное удовлетворение от применения на практике своих знаний. Все это он описал в заметке «Грандиозный эксперимент с канистрой, или Как обезвредить бомбу и перестать беспокоиться» – очевидная ассоциация с книгой Дейла Карнеги. Статья была опубликована в «Журнале химического образования», издающемся Американским химическим обществом – в назидание другим химикам.
Интересно подсчитать концентрацию сернистой кислоты в воде. Домашние бассейны обычно невелики. Пусть его площадь составляет 25 м 2, а глубина 2 м, тогда объем воды равен 50 м 3. Если в канистре было 320 г SO 2(5 моль), то концентрация его в воде составила бы всего 10 –4моль/л (6,4 мг/л). Сернистая кислота относится к кислотам средней силы. При таком разбавлении ее диссоциация по первой ступени H 2SO 3= H ++ HSO – 3проходит практически полностью. Поэтому концентрация ионов водорода в растворе также будет составлять 10 –4моль/л, что дает слабокислую среду с рН = 4.
«Консервированные кристаллы»
В 1989 г. химик из Ленинграда (ныне Петербург) Н. А. Петрова, открыв консервы с дальневосточной треской, обнаружила на рыбьих костях странные комочки. Под сильной лупой эти комочки оказались твердыми прозрачными кристалликами. Испытания показали, что это минерал струвит – двойной фосфат магния и аммония, содержащий кристаллизационную воду: NH 4MgPO 4· 6H 2O. Минерал был назван в честь русского дипломата Генриха Струве (1772–1851).
В природе струвит встречается редко, но вещество этого состава хорошо известно химикам-аналитикам. Осаждение двойного фосфата аммония – магния используют как качественную реакцию на фосфат-анионы или на катионы магния. Реакцию проводят в слабощелочной среде, при которой фосфаты находятся в растворе в виде гидрофосфата: MgCl 2+ Na 2HPO 4+ NH 4OH + 5H 2O = = NH 4MgPO 4 · 6H 2O + 2NaCl. Получается белый мелкокристаллический осадок, который практически нерастворим в воде, но растворяется в разбавленных кислотах. Образование осадка может происходить не сразу; чтобы ускорить кристаллизацию, стенку пробирки надо потереть стеклянной палочкой. Этот старинный прием создает на стенках центры кристаллизации, и дальше выпадение осадка идет легко. При сильном увеличении в осадке видны кристаллы характерной формы. С помощью этой простой реакции можно обнаружить фосфат-анионы в удобрениях и даже в напитках типа «Пепси» или «Фанта» (в небольших концентрациях в них добавляют свободную фосфорную кислоту). Фосфат магния – аммония имеет довольно редкую особенность: его растворимость в воде уменьшается при повышении температуры – от 0,52 г/л при 20 °С до 0,19 г/л при 80 °С. Как же появился струвит в консервах? То, что в рыбьих костях много фосфора, общеизвестно. Богатую фосфором рыбную муку используют как пищевую добавку к корму сельскохозяйственных животных и птиц. Ну а магний в небольших количествах мог попасть в консервы с морской водой. Вот при длительном хранении и выросли в банке мелкие кристаллики. Кстати, для человека они совершенно безвредны.
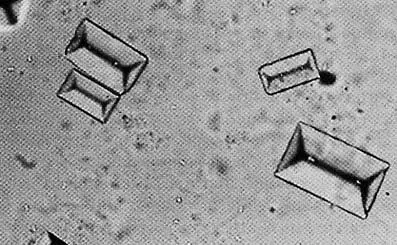
Кристаллы струвита под микроскопом
Не исключено, однако, что кристаллы фосфата выросли на костях еще при жизни рыбы. Ведь кристаллы струвита встречаются при мочекаменной болезни у собак и кошек, а также у людей – в почках и в мочевом пузыре. У рыб мочевого пузыря нет, так что если отложение струвита на костях произошло еще в живой рыбе, то это можно рассматривать как некий аналог подагры – болезни, которую в народе называют отложением солей.
В чем растворяется золото?
Интервал:
Закладка:










