Коллектив авторов - Теоретические основы и практическое применение методов иммуногистохимии
- Название:Теоретические основы и практическое применение методов иммуногистохимии
- Автор:
- Жанр:
- Издательство:Литагент СпецЛит
- Год:2014
- Город:Санкт-Петербург
- ISBN:978-5-299-00596-7
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Коллектив авторов - Теоретические основы и практическое применение методов иммуногистохимии краткое содержание
Настоящее руководство может являться справочным пособием для специалистов, применяющих в своей работе методы иммуногистохимии (врачей-патологоанатомов, судебно-медицинских экспертов, научных работников), а также будет полезно для студентов биологических и медицинских факультетов, изучающих морфологические и нейробиологические дисциплины.
Теоретические основы и практическое применение методов иммуногистохимии - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Применяя определенные методические приемы, можно добиться образования антител к практически неограниченному набору антигенов. Однако стоит отметить, что стоимость коммерческих антител и затраты на их получение в условиях лаборатории могут различаться в десятки раз в зависимости от требуемой чистоты, специфичности и области применения, поэтому еще на этапе планирования исследования стоит уделить особое внимание правильному подбору антител. В этом может помочь и данное руководство.
2.2. Строение антител
Классические антитела представляют собой крупные мультимерные белки. Основная четырехцепочечная структурная единица иммуноглобулинов образована полипептидными цепями двух разных типов. Меньшие по размеру цепи (легкие L-цепи) имеют молекулярную массу около 25 кДа и состоят из вариабельного VL- и константного СL-доменов. Более крупные (тяжелые H-цепи) имеют молекулярную массу 50 – 80 кДа, состоят из вариабельного VH-, трех константных СН1-, СН2-, СН3-доменов и шарнирного участка (hinge region). Полипептидные цепи удерживаются вместе ковалентными (дисульфидными) и нековалентными связями (Ройт А. [и др.], 2000). Схематически «типичная» структура антитела представлена на рис. 1.
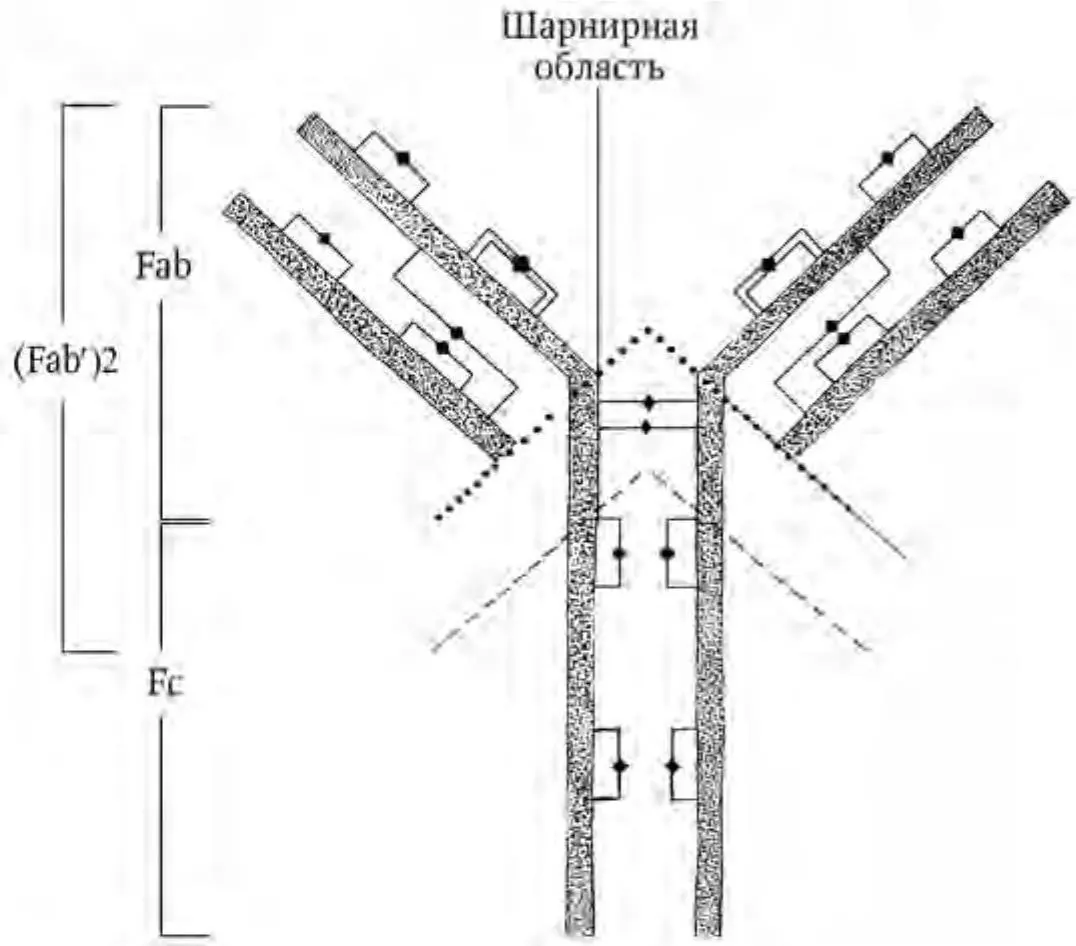
Рис. 1 . Структура кроличьего иммуноглобулина IgG. Тяжелые и легкие цепи образуют вариабельный и константный домены, которые соединены дисульфидными мостиками (♦). При помощи папаина (цистеиновой эндопротеазы) протеолиз разделяет молекулу, в результате чего образуются два антигенсвязывающих фрагмента (Fab) и один кристаллизующийся фрагмент (Fc). Под действием пепсина (аспартатной кислой эндопептидазы) происходит отщепление двухвалентного антигенсвязывающего фрагмента (Fab′)2 (по: Boenisch T., 2001; с изменениями)
В зависимости от размера, заряда, аминокислотной последовательности и содержания углеводов в составе тяжелой цепи различают пять изотипов (классов) антител: IgM, IgG, IgA, IgE и IgD. Класс IgG подразделяется на четыре подкласса (IgG1, IgG2, IgG3, IgG4), которые различаются по антигенной структуре и спектру биологических функций (Burton D. R. [et al.], 1996). IgG – это наиболее широко представленный класс иммуноглобулинов, на его долю приходится 70 – 75 % их общего количества. Класс IgA разделяют на два подкласса (IgA1, IgA2). Все классы и подклассы составляют девять изотипов, которые присутствуют в норме у всех теплокровных. Кроме того, IgM является пентамером, т. е. пять молекул соединяются между собой, а IgA – димером.
При помощи папаина антитела можно расщепить на два одинаковых антигенсвязывающих Fab-фрагмента (fragment antigen binding) и Fc-фрагмент (fragment cristalizable), способный к кристаллизации. Область Fab образована гипервариабельными участками Ни L-цепей и определяет антигенную специфичность; Fc-фрагмент осуществляет эффекторные функции (связывание иммуноглобулина с клетками, компонентами комплемента) (Atassi M. Z., 1984). К Fc-фрагменту антител можно присоединять различные вещества, что используется при постановке иммунохимических реакций.
В 1993 г. группой бельгийских ученых было сделано важное открытие: кроме классических антител в крови некоторых животных (верблюдов, лам и др.) обнаруживаются особые, неканонические антитела с упрощенной структурой. Они состоят из димера укороченной (без CH1-домена) тяжелой цепи; легкая цепь отсутствует, т. е. антигенузнающий участок формируется лишь вариабельными доменами тяжелых цепей. Такие антитела принято называть однодоменными антителами, или мини-антителами. Благодаря малым размерам (молекулярная масса однодоменных антител составляет примерно 12 – 15 кДа) и компактности антигенсвязывающего участка, можно получить мини-антитела, способные узнавать участки антигенов, недоступные для классических антител, в этом состоят весомые преимущества мини-антител (Тиллиб С. В., 2011).
2.3. Особенности связывания антитела с антигеном
В основе любой иммунологической реакции лежит взаимодействие антигена с антителом, которое приводит к формированию комплекса «антиген – антитело». Антигенами обычно являются высокомолекулярные белки и полисахариды, реже – полипептиды, липиды и нуклеиновые кислоты. Иммунный ответ могут вызывать и небольшие молекулы, или гаптены, в том случае если они соединяются с высокомолекулярными носителями (белками, полисахаридами). В качестве гаптенов могут выступать лекарственные вещества, моно- и полисахариды, небольшие полипептиды, фосфолипиды, триглицериды, моноамины.
Небольшой участок антигена, с которым будет связываться антитело, называется эпитопом. Обычно в эпитоп входит от одной до шести молекул моносахаридов или аминокислот, расположенных на поверхности антигена. Антитела распознают не отдельные химические группы в структуре антигена, а пространственную форму эпитопов. Они способны улавливать различия в распределении зарядов на поверхности антигена, оптическую и стереоизомерию, минимальные различия в первичной структуре. Вследствие этого б|ольшая часть антител способна связываться только с нативными антигенами или с фрагментами антигена, сохраняющими третичную структуру. Следовательно, для успешного взаимодействия антигена и антитела эпитоп должен находиться на поверхности молекулы. Следует учитывать, что при денатурации молекул (например, под действием фиксирующих жидкостей, экстремальных значений pH буферных растворов и др.) эпитоп может повышать или понижать свою иммуногенность.
Большие молекулы (например, белки) имеют несколько эпитопов, поэтому они стимулируют образование антител нескольких видов к разным эпитопам одного и того же антигена. Такие антитела называют поликлональными. Они более толерантны к незначительным конформационным изменениям антигена (полиморфизму, различной степени гликозилирования, фосфорилирования, частичной денатурации), что дает больше возможностей экспериментатору при планировании исследований.
Антитела, реагирующие с одним единственным эпитопом, называют моноклональными. В отличие от поликлональных антител, они чувствительны даже к небольшим конформационным изменениям антигена. Например, можно получить моноклональные антитела, узнающие молекулу белка, фосфорилированную по определенному сайту. Благодаря высокой специфичности моноклональные антитела являются отличными первичными антителами, то есть антителами для выявления искомого антигена, так как они дают слабое неспецифическое связывание, а значит, и меньшее фоновое окрашивание. По сравнению с поликлональными антителами они обладают большей гомогенностью, что обеспечивает высокую воспроизводимость результатов. Однако связывание с единственным эпитопом обусловливает низкую чувствительность, проявляющуюся в слабом иммуноокрашивании на срезах. К тому же высока вероятность того, что фиксатор сделает этот единственный эпитоп недоступным для антител, в результате чего иммуноокрашивания вообще не произойдет. Кроме того, методы получения моноклональных антител более сложные и трудоемкие, чем методы получения поликлональных иммунных сывороток, что приводит к значительному увеличению их стоимости.
Читать дальшеИнтервал:
Закладка: