Коллектив авторов - Раневой процесс: нанобиотехнологии оптимизации
- Название:Раневой процесс: нанобиотехнологии оптимизации
- Автор:
- Жанр:
- Издательство:Литагент СпецЛит
- Год:неизвестен
- ISBN:978-5-299-00509-7
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Коллектив авторов - Раневой процесс: нанобиотехнологии оптимизации краткое содержание
Издание предназначено для специалистов хирургического профиля, специалистов, работающих в области нормальной и патологической физиологии, преподавателей и студентов медицинских и биологических вузов, а также специалистов технического профиля, интересующихся проблемой нанобиотехнологий.
Раневой процесс: нанобиотехнологии оптимизации - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Эндогенные факторы:
1. Малигнизация собственных клеток организма и реакция на опухоль.
2. Потеря иммунологической толерантности по отношению к клеткам собственного организма.
Воспаление – это системная защитная реакция, преследующая главную биологическую цель – уничтожение и элиминацию всего, что организм считает чужеродным. При достижении этой цели организм, прежде всего, решает следующие промежуточные задачи: локализировать зону воспаления – очаг инфекции, зону некробиотических изменений тканей, клон злокачественных клеток и предотвратить тем самым развитие системной аутоиммунной реакции.
Под чужеродными следует понимать не только инородные частицы или микроорганизмы, попавшие во внутреннюю среду, но и свои некробиотически измененные и переродившиеся клетки, представляющие собой «транзиторный орган внутренней секреции», функционирование которого имеет исключительно патогенное значение. Подвергшиеся цитолизу клетки приобретают свойство антигенной стимуляции системы иммунитета. Изменения наружной клеточной мембраны некробиотически измененных клеток приводят к активации на них системы комплемента по альтернативному пути. Активация системы комплемента вызывает воспаление. Совокупность клеточных, биохимических, физиологических и морфологических процессов, последовательно развивающихся в ране, называется раневым процессом (Зайчик А. Ш., 2005; Литвицкий П. Ф., 2007). С точки зрения общей патологии раневой процесс представляет собой частный вариант воспаления, которое определено как типовой патологический процесс, развивающийся в васкуляризованных органах и тканях в ответ на любое местное повреждение и проявляющийся в виде поэтапных изменений микроциркуляторного русла, крови и стромы органа или ткани, направленных на локализацию, разведение, изоляцию и устранение агента, вызвавшего повреждение, и на восстановление поврежденной ткани (Шанин В. Ю., 1998). В ходе восстановления происходит регенерация или замещение утраченных паренхиматозных элементов органа и/или фиброплазия – замещение дефекта соединительной рубцовой тканью.
Так как раневой процесс является воспалением, то в своем течении он должен проходить стадии альтерации, экссудации и пролиферации. Однако клинически оказалось удобнее выделять следующие его стадии (Шанин В. Ю., 1998):
а) фаза воспаления, включающая период сосудистых изменений и очищения раны;
б) фаза регенерации, в течение которой происходит образование и созревание грануляционной ткани;
в) фаза реорганизации рубца и эпителизации.
Фаза воспаления начинается с момента ранения и длится около 3—4 суток. Совокупность изменений в месте повреждения в период данной фазы характеризуется двумя основными, тесно связанными между собой процессами – альтерацией и экссудацией.
Изменения обмена веществ, физико-химических свойств, структуры, функции клеток и тканей, возникающие в момент повреждения (ранения), называются первичной альтерацией. Повреждение тканей приводит к активации клеток и высвобождению медиаторов воспаления, взаимодействие которых между собой обуславливает развитие местной и системной острой воспалительной реакции.
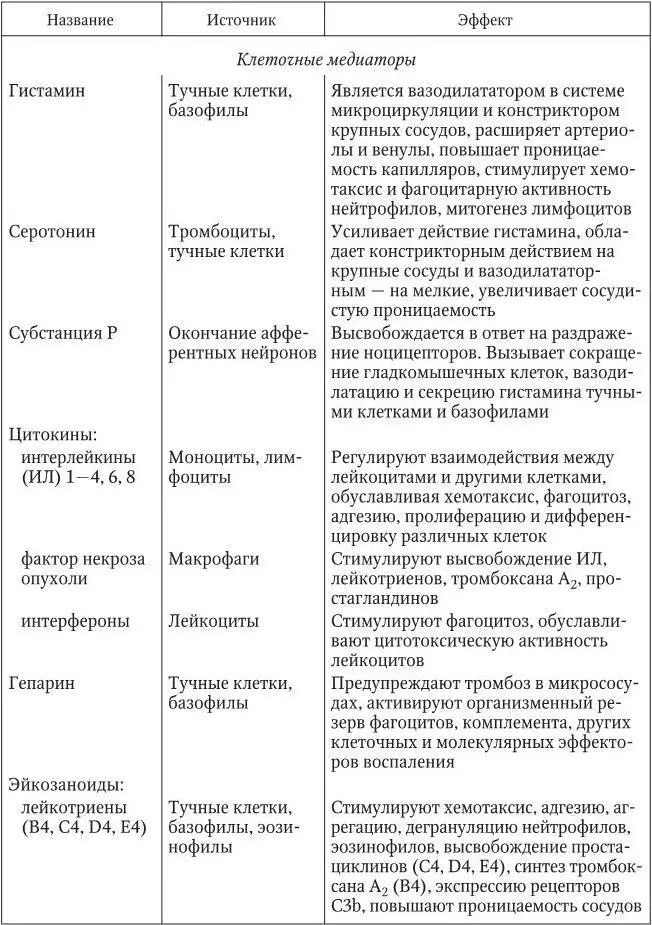
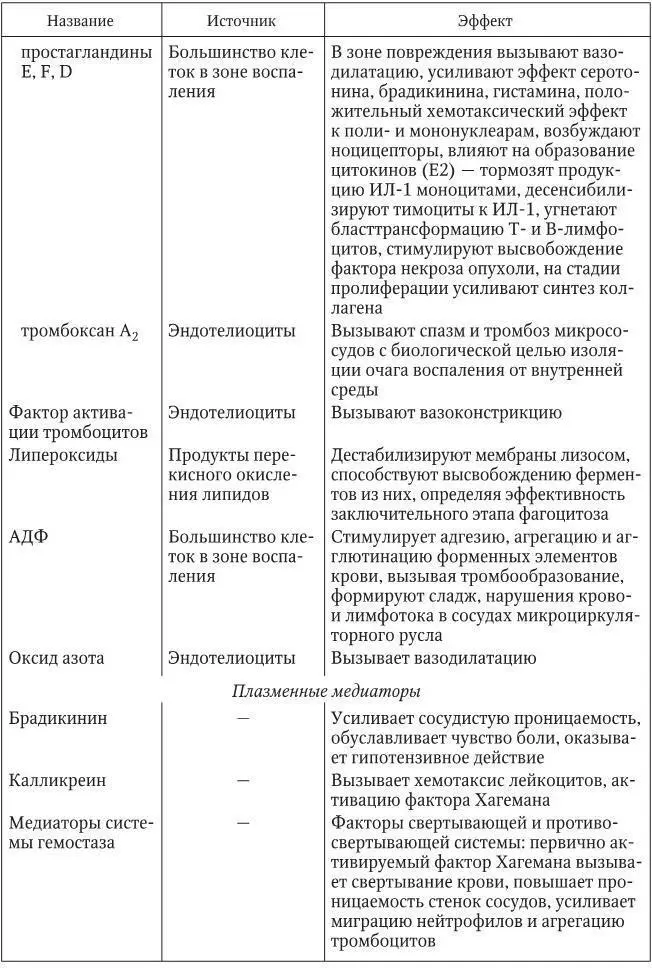
Медиаторы воспаления имеют как вне-, так и внутриклеточное происхождение и характеризуются определенными функциями (табл. 1).
Помимо медиаторов воспаления существуют биологически активные вещества, предупреждающие их избыточное накопление и действие. Так, относящиеся к таким веществам ферменты – гистаминаза, карбоксипептидаза, эстераза – разрушают соответственно гистамин, кинины, фракции комплемента. Ингибиторы протеолиза ослабляют действие трипсина, глюкокортикоиды снижают выраженность сосудистых реакций и стабилизируют мембраны сосудов. Обмен веществ в очаге воспаления характеризуется преобладанием реакций катаболизма (Литвицкий П. Ф., 2007; Попов В. А., 2003). Происходит перестройка всех видов обмена веществ – углеводного, белкового, жирового и водно-солевого. Активируется гликогенолиз и гликолиз, нарушается образование АТФ, гликолиз переходит на анаэробный путь, вследствие чего происходит накопление избытка лактата и пирувата. Усиление липолиза приводит к чрезмерному образованию свободных высших жирных кислот и кетокислот. В результате указанных изменений развивается метаболический ацидоз. Нарушение баланса между вне- и внутриклеточными ионами значительно увеличивает осмотическое давление внутри клеток и их органелл, что сопровождается перерастяжением и разрывом мембран. Указанные изменения позволили определить состояние метаболизма при воспалении термином «пожар обмена».
Таблица 1
Основные медиаторы воспаления(Литвицкий П. Ф., 2007)

Аналогия заключается не только в том, что обмен веществ в очаге воспаления резко повышен, но и в том, что «горение» происходит не до конца, а с образованием недоокисленных продуктов (полипептиды, жирные кислоты, кетоновые тела), обуславливающих развитие ацидоза.
Продукты первичной альтерации и клетки – участницы воспаления могут вызвать вторичное самоповреждение тканей, получившее название вторичной альтерации. Изменения микроциркуляции в очаге воспаления и прилежащих к нему тканях обуславливают значительное падение напряжения кислорода (Попов В. А., 2003). Гипоксия и связанный с ней гипоэргоз клеточных элементов вызывают развитие гипоксического тканевого некробиоза, который под действием агентов вторичной альтерации переходит в некроз, получивший название вторичного.
Вторичные повреждения тканей могут происходить по кислородзависимому (активные формы кислорода) и кислороднезависимому (гидролитические ферменты, конечный продукт активации комплемента) механизмам.
Кислородзависимые повреждения связаны с массивным образованием лейкоцитами активных кислородных радикалов, приводящих к активации процессов перекисного окисления липидов (ПОЛ) плазмы крови и клеточных мембран. Показано, что в основе формирования вторичных повреждений тканей в зоне воспаления, особенно в случае огнестрельных и гнойных ран, лежит состояние «окислительного стресса», сущностью которого является активация процессов перекисного окисления липидов на фоне нарушения функционирования системы эндогенной антиоксидантной защиты. Образующиеся при этом активные формы кислорода (АФК) и перекиси, нарастающий протеолиз и местный ацидоз усиливают деструкцию клеток, дистрофические процессы, приводя к увеличению объема повреждения, формированию вторичных некрозов, усилению микроциркуляторных расстройств. Среди АФК наиболее важное значение имеют супероксиданион-радикал (O 2 •−), гидроксилрадикал (•ОН), пергидроксильный радикал (НOO•), пероксил-радикал (RОО•) и молекулярный синглетный кислород ( 1О 2). Повреждающие ткани АФК образуются в течение первых часов и достигают своего пика на 4—5-е сутки.
Читать дальшеИнтервал:
Закладка: