Ричард Фейнман - 1. Современная наука о природе, законы механики
- Название:1. Современная наука о природе, законы механики
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ричард Фейнман - 1. Современная наука о природе, законы механики краткое содержание
1. Современная наука о природе, законы механики - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
причем величина s называется стандартным отклонением.
В нашем случае s = Ц N или ЦN S c - k , если средняя квадратичная длина шага отлична от единицы.
Мы уже говорили о том, что движения молекул или каких-то других частиц в газе похожи на случайные блуждания. Представьте себе, что мы открыли в комнате пузырек с духами или каким-то другим органическим веществом. Тотчас же молекулы его начнут испаряться в воздух. Если в комнате есть какие-то воздушные течения, скажем циркуляция воздуха, то они будут переносить с собой пары этого вещества. Но даже в совершенно спокойном воздухе молекулы будут распространяться, пока не проникнут во все уголки комнаты. Это можно определить по запаху или цвету. Если нам известен средний размер «шага» и число шагов в секунду, то можно подсчитать вероятность обнаружения одной или нескольких молекул вещества на некотором расстоянии от пузырька через какой-то промежуток времени. С течением времени число шагов возрастает и газ «расползается» по комнате, подобно нашим кривым на фиг. 6.7. Длина шагов и их частота, как вы узнаете впоследствии, связаны с температурой и давлением воздуха в комнате.
Вы знаете, что давление газа вызывается тем, что молекулы его бомбардируют стенки сосуда. Позднее, когда мы подойдем к количественному описанию этого явления, нам понадобится знать, с какой скоростью движутся молекулы, ударяясь о стенку, поскольку сила их ударов зависит от скорости. Однако говорить о какой-то определенной скорости молекул совершенно невозможно. В этом случае необходимо использовать вероятностное описание. Молекула может иметь любую скорость, но некоторые скорости предпочтительнее других. Все происходящее в газе можно описать, сказав, что вероятность того, что данная молекула движется с какой-то скоростью между v и v+Dv, будет равна p(v) D v, где р(v) — плотность вероятности, которая зависит от скорости v. Позднее я расскажу, как Максвелл, используя общие понятия и идеи теории вероятности, нашел математическое выражение для функции p(v). Примерный вид функции p(v) показан на фиг. 6.9.
䚠ᢜ
Фиг. 6.9. Распределение молекул газа по скоростям.
Скорость может иметь любую величину, однако больше шансов за то, что она окажется где-то в окрестности наиболее вероятного или ожидаемого значения
.
О кривой, показанной на фиг. 6.9, часто говорят в несколько ином смысле. Если мы возьмем газ, заключенный в каком-то сосуде (скажем, объемом 1 л), то окажется, что в нем имеется огромное количество молекул (N » 10 22). Поскольку р(v) Dv — вероятность того, что первая попавшаяся молекула будет лететь со скоростью, находящейся в интервале Dv, то, по определению, ожидаемое число молекул со скоростью, находящейся в этом же интервале, будет равно
< DN>=Np(v) Dv . (6.21)
Поэтому Np (v) можно назвать «распределением молекул по скоростям». Площадь под кривой между двумя значениями скоростей v l и v 2[заштрихованная область на фиг. 6.9 для кривой Np(v)] представляет ожидаемое число молекул со скоростями между v 1и v 2 . Но в газе, который содержит обычно огромное число молекул, отклонения от ожидаемого значения будут очень малы (порядка 1/ЦN), поэтому часто мы выбрасываем слово «ожидаемое» и говорим просто: «Число молекул со скоростями между v 1 и v 2 равно площади заштрихованного участка».Однако нужно все-таки помнить, что речь в таких случаях всегда идет о вероятном числе.
§ 5. Принцип неопределенности
Понятия вероятности оказались очень полезны при описании поведения газа, состоящего из огромного количества молекул. Немыслимо же в самом деле пытаться определить положение и скорость каждой из 10 22молекул! Когда впервые теория вероятности была применена к таким явлениям, то это рассматривалось просто как удобный способ работы в столь сложной обстановке. Однако теперь мы полагаем, что вероятность существенно необходима для описания различных атомных процессов. Согласно квантовой механике, этой математической теории малых частичек, при определении положения частички и ее скорости всегда существует некоторая неопределенность. В лучшем случае мы можем только сказать, что существует какая-то вероятность того, что частица находится вблизи точки х.
Для описания местоположения частицы можно ввести плотность вероятности р 1 (х), так что p 1(x) Dx будет вероятностью того, что частица находится где-то между х и х +Dx. Если положение частицы установлено достаточно хорошо, то примерный вид функции P 1 (x) может иллюстрировать график, приведенный на фиг. 6.10, а.
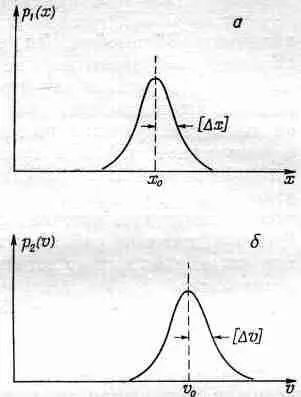
Фиг. 6.10. Плотности вероятности координаты, (а) и скорости (6) частицы.
Точно такое же положение и со скоростью частицы: она тоже неизвестна нам точно. С некоторой вероятностью р 2(v) Dvчастица может двигаться со скоростью, находящейся в интервале между v и v +Dv.
Один из основных результатов квантовой механики состоит в том, что эти две плотности р 1 (х) и р 2 (v) не могут быть выбраны независимо в том смысле, что они обе не могут быть сколь угодно узкими. Если мы возьмем «полуширины» кривых p 1 (х) и p 2 (v) и обозначим их соответственно [Dx] и [Dv] (см. фиг. 6.10), то природа требует, чтобы произведение этих двух полуширив было не меньше величины h/m, где m — масса частицы, a h — некоторая фундаментальная физическая постоянная, называемая постоянной Планка. Это соотношение записывается следующим образом:
[Dx][Dv]>=h/m (6.22)
и называется принципом неопределенности Гейзенберга.
Чтобы это соотношение выполнялось, частица должна себя вести очень курьезно. Вы видите, что правая часть соотношения (6.22) постоянна, а это означает, что если мы попытаемся «приколоть» частицу в каком-то определенном месте, то эта попытка окончится тем, что мы не сможем угадать, куда она летит и с какой скоростью. Точно также если мы попытаемся заставить частицу двигаться очень медленно или с какой-то определенной скоростью, то она будет «расплываться», и мы не сможем точно указать, где она находится.
Принцип неопределенности выражает ту неясность, которая должна существовать при любой попытке описания природы. Наиболее точное и полное описание природы должно быть только вероятностным. Однако некоторым физикам такой способ описания приходится не по душе. Им кажется, что о реальном поведении частицы можно говорить только, когда одновременно заданы импульсы и координаты. В свое время на заре развития квантовой механики эта проблема очень сильно волновала Эйнштейна. Он часто качал головой и говорил: «Но ведь не гадает же господь бог «орел — решка», чтобы решить, куда должен двигаться электрон!» Этот вопрос беспокоил его в течение очень долгого времени, и до конца своих дней он, по-видимому, так и не смог примириться с тем фактом, что вероятностное описание природы — это максимум того, на что мы пока способны. Есть физики, которые интуитивно чувствуют, что наш мир можно описать как-то по-другому, что можно исключить эти неопределенности в поведении частиц. Они продолжают работать над этой проблемой, но до сих пор ни один из них не добился сколько-нибудь существенного результата.
Читать дальшеИнтервал:
Закладка:




![Ричард Фейнман - Фейнмановские лекции по физике. Современная наука о природе [litres]](/books/1068056/richard-fejnman-fejnmanovskie-lekcii-po-fizike-sov.webp)


