Лев Николаев - Металлы в живых организмах
- Название:Металлы в живых организмах
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1986
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Лев Николаев - Металлы в живых организмах краткое содержание
Металлы в живых организмах - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Лиганды могут нести электрический заряд, т. е. быть ионами. В таких случаях заряд всего комплексного иона получается алгебраическим суммированием заряда всех лигандов и заряда центрального иона. Примером может служить комплексное соединение иона железа (II) с цианид-ионами CN -. Комплекс [Fe(CN) 6] 4-имеет отрицательный заряд, так как центральный ион заряжен двумя положительными, а шесть ионов-лигандов несут шесть отрицательных зарядов. Комплексный ион может удерживать четыре однозарядных катиона, например четыре иона калия. Выделенная из раствора комплексная соль имеет состав K 4[Fe(CN) 6].
Число лигандов, располагающихся в непосредственной близости от центрального иона, называют координационным числом иона (сокращенно его обозначают КЧ). Часто встречаются координационные числа 2, 4, 6; числа 3, 5, 7 встречаются крайне редко. Известны и очень большие координационные числа — 8, 12, 18. В таблице 3 приведены некоторые примеры типичных координационных соединений [1] В современной научной литературе комплексные соединения часто называют координационными; оба термина равнозначны.
с различными КЧ.
Величина координационного числа определяется относительными размерами иона и лигандов и величиной электрического заряда центрального иона. Большой заряд и малые размеры иона благоприятствуют высоким координационным числам.
Таблица 3. Координационные числа некоторых комплексных соединений (комплексных ионов) и их геометрическая форма
[Ag(NH 3) 2] +| 2 | Линейная
[HgI 3] -| 3 | Треугольник
[Cu(NH 3) 4] 2+, [PtCl 4] 2-| 4 | Квадрат
[MnCl 5] 3-| 5 | Пирамида
[PtCl 6] 2-, [Ca(H 2O) 6] 2+, [Fe(CN) 6] 4-| 6 | Октаэдр
[Zr(C 2O 4) 4] 4-| 8 | Куб
Иногда в молекуле органического соединения находятся две или более групп, способных присоединяться к иону металла. В таких случаях одна молекула-лиганд занимает вблизи от иона (в так называемой координационной сфере иона) не одно, а два или более мест.
Примером может служить уже упоминавшееся соединение иона меди с молекулами этилендиамина. Этилендиамин H 2N-СН 2-СН 2-NH 2имеет в составе две группы — NH 2, активно присоединяющиеся к иону меди, и каждая молекула занимает два места в координационной сфере:
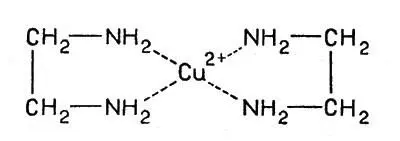
Cоединение иона меди с молекулами этилендиамина
Как видно из формулы, комплексообразование в этом случае приводит к возникновению циклов: ион меди, соединяясь с атомами азота, замыкает два цикла (пунктир обозначает связи между ионом и атомами азота лиганда). Такие комплексы называют хелатными ("клешнеобразными").
В таблице 3 указано соединение иона циркония с анионами щавелевой кислоты. Здесь лигандом является отрицательно заряженный ион С2O4-. Формула щавелевой кислоты:
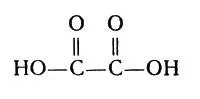
Формула щавелевой кислоты
Формула аниона:
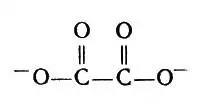
Формула аниона щавелевой кислоты
Каждый анион занимает два координационных места; всего четыре таких частицы-лиганда занимают восемь мест, поэтому координационное число циркония равно 8.
По мере расширения круга исследований неорганических и органических веществ число комплексных соединений металлов с различными лигандами все увеличивалось. Постепенно выяснилось, что перед химиками открывается совершенно новая область науки, имеющая первостепенное значение для решения целого ряда теоретических и практических вопросов. Ученым пришлось заново пересмотреть теорию химической связи и понятие валентности. Большой вклад в учение о комплексных соединениях внесли русский ученый Л. А. Чугаев и его ученики, синтезировавшие множество новых веществ и изучившие их свойства. Позже успешная работа над координационными соединениями была продолжена в исследованиях школы акад. И. И. Черняева, А. А. Гринберга, физико-химиков Л. Полинга, Р. Пирсона, К. Бальхаузена и др.
Достижения химии комплексных соединений оказали сильное влияние на развитие биохимии. Если ранее можно было только констатировать, что металлы — железо, медь, кобальт, цинк и др. — необходимы для жизни организмов, то теперь удалось раскрыть механизм их работы и понять, что ион металла всегда действует в форме комплекса.
Для биохимии особенно важны комплексные соединения железа и магния, в которых четыре координационных места занимает одна частица, называемая порфином:
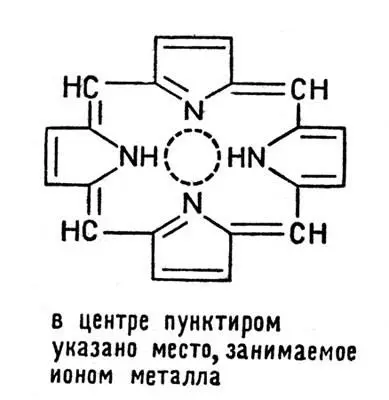
Комплексные соединения железа и магния
Практически в организмах встречаются комплексы, в которых некоторые атомы водорода в порфине замещены на различные органические группы -СН 3, -СН 2-СН 2-СООН и др., но основной каркас этой сложной молекулы сохраняется в целом ряде важнейших веществ: в гемоглобине, хлорофилле и в различных ферментах, ускоряющих процессы обмена веществ.
Молекулы комплексных (координационных) соединении отличаются вполне определенной геометрической структурой. Так, два одинаковых лиганда часто располагаются около иона металла таким образом, что центры иона и частиц-лигандов оказываются на одной прямой. Три лиганда размещаются по углам треугольника, четыре — по углам квадрата или четырехгранника (тетраэдра) шесть — по углам восьмигранника (октаэдра) (рис. 1), восемь — по углам куба. Если лиганды неодинаковы, то геометрические формы могут быть и не совсем правильными (искаженными), но тем не менее лиганды остаются фиксированными в определенных точках пространства вокруг центрального иона. В последнем столбце таблицы 3 указаны характерные геометрические формы некоторых координационных соединений, образующих в растворах ионы с различными КЧ.
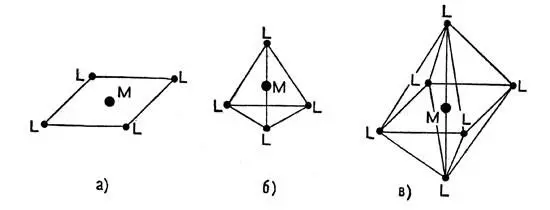
Рис. 1. Расположение лигандов (L) вокруг центрального иона в комплексных соединениях: а — квадрат; б — тетраэдр; в — октаэдр. Центральный ион отмечен буквой М
Геометрическая форма того или иного комплексного иона сохраняется и в том случае, когда вещество выделяют из раствора в виде кристаллов. Следовательно если, например из раствора соли K 2PtCl 6, содержащего ноны К +и [PtCl 6] 2-, выделить кристаллы этой соли то и в кристаллах сохранятся октаэдры (восьмигранники) PtCl 6 2-, т. е. анионы наряду с катионами — ионами калия К +.
Устойчивость геометрической формы комплексного нона ведет к двум важным следствиям.
Читать дальшеИнтервал:
Закладка: