Лев Николаев - Металлы в живых организмах
- Название:Металлы в живых организмах
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1986
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Лев Николаев - Металлы в живых организмах краткое содержание
Металлы в живых организмах - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Глава 4. Ферменты и металлы
Ферментами называют природные белковые катализаторы. Некоторые ферменты имеют чисто белковый состав и не нуждаются для проявления своей активности в каких-либо иных веществах. Однако существует обширная группе ферментов, активность которых проявляется только в присутствии определенных соединений небелковой природы. Эти соединения называются кофакторами. Кофакторами могут быть, например, ионы металлов или органические соединения сложного строения — их обычно называют коферментами. В большинстве случаев связь между коферментом и белком слабая и кофермент можно отделить от белка. Субстратом называется вещество, которое изменяется под действием фермента.
Известны сочетания кофермента с белком, в которых связи между ними прочны и разделить кофермент и белок можно только с большим трудом. Тогда вместо "кофермент" применяют термин "простетическая группа". Такие прочные связи обнаружены в ферментах, содержащих гем — комплексное соединение железа с производным порфина, упоминавшееся в предыдущей главе. В качестве активаторов-кофакторов в ферментах встречаются ионы железа, меди, цинка, магния, марганца, калия, натрия, молибдена. Роль коферментов в важнейших процессах, катализируемых ферментами, играют сложные вещества, молекулы которых иногда представляют сочетание нескольких звеньев, состоящих из органических оснований, углеводных остатков, остатков аминокислот и т. п.
Многие коферменты являются витаминами и жизненно необходимы для организма. Установлено, что для нормальной работы фермента иногда требуется и кофермент, и ион металла, образующие вместе с молекулой субстрата тройной комплекс. Так металлы входят в состав биологических машин как незаменимая часть. Ионы магния нужны для работы по переносу остатков фосфорной кислоты, для этих же целей нужны и ионы калия; гидролиз белков требует ионов цинка и т. д. Ниже мы разберем эти вопросы детально.
Ферменты, как правило, ускоряют однотипные реакции, и лишь немногие из них действуют только на одну определенную и единственную реакцию. К таким ферментам, обладающим абсолютной специфичностью, относится, в частности, уреаза, разлагающая мочевину. Большинство ферментов не столь строги в выборе субстрата. Одна и та же гидролаза, например, способна катализировать гидролитическое разложение нескольких различных сложных эфиров.
По мере того как в биологических исследованиях их химическая сторона углублялась и химики все чаще становились помощниками и сотрудниками биологов, число вновь открываемых ферментов неуклонно возрастало; вскоре их пришлось считать уже не десятками, а сотнями. Такое расширение круга биологических катализаторов вызвало некоторые трудности в классификации и номенклатуре ферментов.
Раньше ферменты называли по тому субстрату, на который они действовали, с прибавлением окончания "аза". Так, если фермент действует на сахар мальтозу, то его называли "мальтаза", если на лактозу — "лактаза" и т. д. В настоящее время принята номенклатура, в которой название отражает также и химическую функцию фермента. Частица "аза" сохранена для простых ферментов. Если же в реакции участвует комплекс ферментов, применяют термин "система".
Ферменты делят на шесть классов:
1. Оксидоредуктазы. Это ферменты, катализирующие окислительно-восстановительные реакции. Примером оксидоредуктаз могут служить пируватдегидрогеназа, отнимающая водород от пировиноградной кислоты, каталаза, разлагающая пероксид водорода, и др.
2. Трансферазы. Трансферазы осуществляют перенос с одной молекулы на другую целых атомных групп. Они могут переносить группы СН3, СООН, Н2РО3 и др.
3. Гидролазы. Эти ферменты вызывают разрыв связей типа
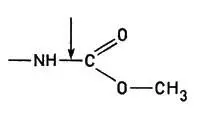
4. Гидролазы вызывают разрыв связей
и подобные им с последующим присоединением воды:
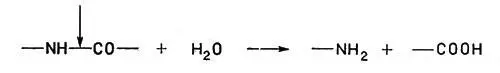
5. Гидролазы вызывают разрыв связей с последующим присоединением воды
К гидролазам относятся пищеварительные ферменты пепсин, химотрипсин и др., а также липазы, расщепляющие жиры.
6. Лиазы. Лиазы тоже расщепляют связи С-С, С-N, С=O и др., но без участия воды, т. е. негидролитическим путем.
7. Изомеразы. Эти ферменты способствуют частичной перестройке молекул субстрата.
8. Лигазы. Лигазы обеспечивают соединение молекул субстрата, причем энергия, необходимая для этого, доставляется аденозинтрифосфатом (АТФ).
Уже простое перечисление этих функций наводит на мысль, что ферменты действуют в клетках не в одиночку, а совместно, последовательно перекраивая молекулы пищевых веществ: разрывая одни связи, создавая другие, изменяя общий каркас молекулы, перенося на нее или отнимая от нее целые группы атомов и т. д. Ферменты, в отличие от большинства технических катализаторов, функционируют в составе сложных систем; работа их согласована так, что продукт деятельности одного фермента обязательно попадает в сферу влияния вполне определенного другого, и скорости превращений на всех стадиях химического конвейера клетки также строго согласованы и регулируются автоматически.
Клетка и организм располагают и средствами управления своими "химическими заводами", так как клетка не только пользуется ферментами, но и сама создает их. Если при данных условиях работу какой-либо цепочки ферментов необходимо прекратить, так как вырабатываемый ею продукт имеется в избытке, выключается синтез соответствующих ферментов или подавляется деятельность одного из них, и таким образом весь конвейер временно останавливается. Это значит, что ферментная система пространственно организована. Она организована также во времени, потому что ферменты активируются и даже появляются в большей концентрации в те моменты, когда клетка нуждается в их деятельности.
Молекулярная масса ферментов велика и измеряется десятками, сотнями тысяч и даже миллионами. Ниже (табл. 5) приведены молекулярные массы некоторых ферментов.
Изучение химического состава ферментов показало, что все они без исключений содержат белок. Белковая природа ферментов объяснила многие детали их синтеза в клетках, причины, по которым они легко фиксируются на мембранах. И вместе с тем появилась важная проблема в теории катализа — вопрос о механизме действия биологических катализаторов, которые, обладая очень сложной геометрической структурой, не являются вполне "жесткими", подобно кристаллическим оксидам или металлам, а могут изменяться уже в процессе каталитической реакции.
Читать дальшеИнтервал:
Закладка: