Николай Бетенеков - Избранные главы курса Радиохимия
- Название:Избранные главы курса Радиохимия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2018
- ISBN:978-5-532-11043-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Бетенеков - Избранные главы курса Радиохимия краткое содержание
Избранные главы курса Радиохимия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Если, например, рассматривать комплексообразование с галогенидами, то для различных катионов будет наблюдаться различная закономерность устойчивости образующихся комплексов. Первые константы образования уменьшаются в следующей последовательности:

Таким же образом можно классифицировать не только комплексообразователи, но и лиганды. Отличие надо искать в свойствах их электронной структуры и реакционной способности.
Жесткие частицыобладают прочной малодеформируемой электронной структурой. Это могут быть атомы элементов с высокой электроотрицательностью (F, O, N) или катионы с большим зарядом. Напротив, мягкие частицыимеют подвижную деформируемую электронную структуру и высокую поляризуемость.
Жесткие кислоты. Электронная оболочка жестких кислот характеризуется высокой стабильностью относительно внешних электрических полей. Наиболее жесткой кислотой является протил, который из-за отсутствия электронной оболочки и чрезвычайно малого радиуса прочно связывается с активным центром молекулы основания. Следовательно, характеризуется наименьшим размером, во внешней сфере нет неподеленной пары электронов. Типичные представители жестких кислот имеют структуру инертного газа Li +, Be 2+, Al 3+… и относятся, в основном, к элементам главных подгрупп периодической системы. К последним близки по свойствам некоторые катионы переходных металлов с не полностью занятой d -оболочкой (Mn 2+, Fe 3+…).
Жесткие основаниявследствие прочной и устойчивой электронной оболочки, а также соответствующего строения электронных орбиталей не имеют склонности к образованию ковалентных связей с катионом (F -, O 2-). Рассматривая реакционную способность воды, как донора пары электронов. Можно отметить, что, например, при гидратации катионов, кислород молекулы вода как раз и является жестким центром. Анионы кислородсодержащих кислот, таких как ClO 4 -, SO 4 2-, PO 4 3-, CO 3 2-также имеют малодеформируемую структуру.
В противоположность, мягкие кислоты– большие катионы с деформируемой электронной оболочкой (например, элементы главных подгрупп Cs +, Tl +) а также катионы переходных металлов, в электронной оболочке которых имеются неподеленные пары электронов. Способность к поляризуемости у них выше. Мягкость соединений увеличивается по мере уменьшения положительного заряда ионов.
Аналогично и мягкие основания(P 3-, S 2-, I -, Br -), способность к поляризуемости у которых высока.
Анализируя константы устойчивости комплексов, можно сделать вывод, что жесткие кислоты образуют наиболее прочные соединения с жесткими основаниями, а мягкие кислоты – с мягкими основаниями. Большое значение имеет и то, каким образом формируется соответствующее соединение, что определяет молекулярный контакт при образовании этого соединения:

Таким образом, можно провести классификацию комплексообразователей и лигандов (табл.1.2).
Таблица 1.2.
Распределение кислот и оснований по Пирсону.
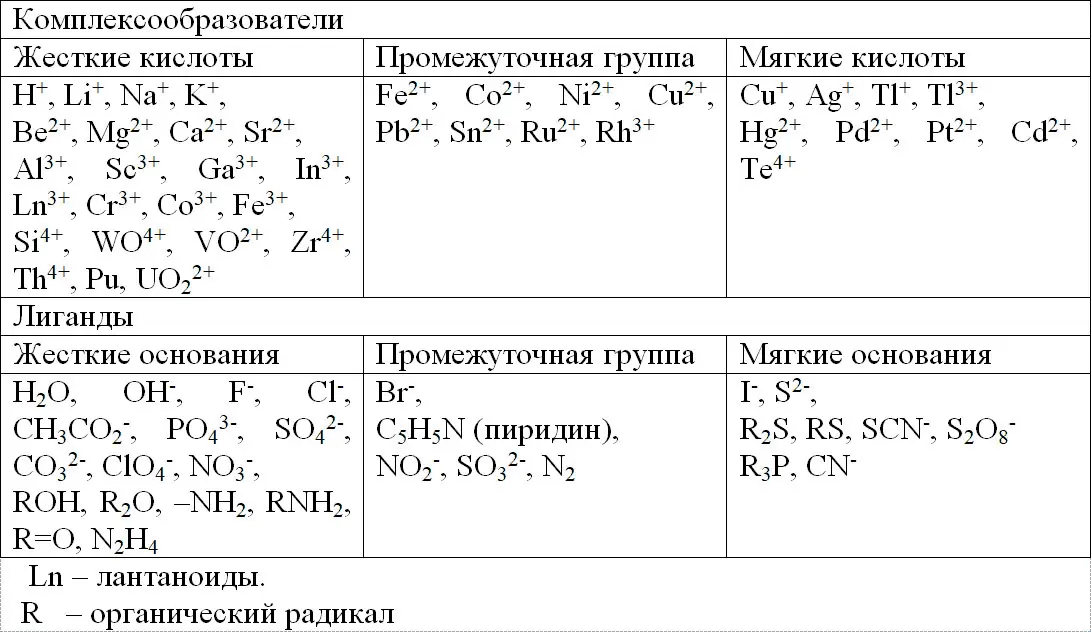
Актиноиды – типичные жесткие кислоты, для них выполняется следующая зависимость: М 4+> M 3+> MO 2 2+> МO 2 +. Жесткие кислоты, взаимодействуя с жесткими основаниями, образуют соединения, прочность которых подчиняется величине ионного потенциала.
Приведенное высказывание, что жесткие кислоты предпочтительно ассоциируются с жесткими основаниями, а мягкие кислоты – с мягкими основаниями, не означает, что не могут быть получены соединения жесткой кислоты с мягким основанием и наоборот. Например, CH 3 -является мягким основанием, однако легко можно получить соединение типа Mg(CH 3) 2. Тем не менее это соединение термодинамически неустойчиво в отношении гидролиза, тогда как Hg(CH 3) 2устойчиво к гидролизу. Теория жестких и мягких кислот и оснований оказалась полезной для предсказания наиболее стабильных продуктов реакций, для которых не имеется достаточно точных термодинамических характеристик.
Некоторые молекулы имеют как жесткие, так и мягкие центры. В диметилсульфоксиде
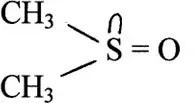
атом кислорода придает жесткие свойства всему соединению, а атом серы – мягкие свойства. Поэтому жесткие кислоты прочно связываются с атомом O, мягкие кислоты – с атомом S. Подобные свойства реализуются для многих органических соединений, которые используются в экстракционных системах.
С помощью теории жестких и мягких кислот и оснований можно предсказать продукты обменной реакции между солями
LiI + AgF ↔ LiF + AgI.
В результате реакции, протекающей в растворе или в твердой фазе, образуются более стабильные соединения между жесткой кислотой и жестким основанием LiF и мягкой кислотой и мягким основанием AgI.
Становится понятным, почему происходит стабилизация металлов с высокой степенью окисления (Th 4+, UO 2 2+) жесткими основаниями (F -, OH -, O 2-) и наоборот.
Таким образом, все ионы металлов стремятся к образованию координационных соединений, вероятно так же и то, что все молекулы и ионы, имеющие по крайней мере одну свободную пару электронов, стремятся к взаимодействию с ионами металлов с образованием комплексов.
В зависимости от способности к комплексообразованию ионы металлов можно разделить на три группы.
1. Ионы металлов с электронной структурой инертного газа, т. е. щелочные, щелочно-земельные, лантаноиды и актиноиды. Все они образуют комплексы со связями электростатического характера. Ионы этих металлов взаимодействуют с анионами небольшого размера, в особенности F -и с лигандами, содержащими в качестве донорных атомов атомы кислорода. Имеют тенденцию образовывать в водных растворах акво-комплексы и не образуют комплексы с аммиаком, сульфидами и не осаждаются ими. Т. к. связи этих металлов носят прежде всего ионный характер, то устойчивость комплексов тем выше, чем больше электронная плотность на ионе металла (ионный потенциал).
2. Ионы переходных металлов с d 10или d 8электронной конфигурацией: Cu (I), Ag (I), Au (I), Hg (II), Pt (II), Pd (II). Легко деформирующиеся ионы этих металлов склонны к образованию ковалентных связей. Они образуют очень устойчивые комплексы, для образования которых, прежде всего, важна электроотрицательность лиганда. Связи тем прочнее, чем ниже электроотрицательность донорного атома лиганда. Устойчивы комплексы с лигандами, содержащими в качестве донорных атомов S (II), As (III), P (III). Наименее прочные комплексы образуют с F -.
Читать дальшеИнтервал:
Закладка:










