Николай Бетенеков - Избранные главы курса Радиохимия
- Название:Избранные главы курса Радиохимия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2018
- ISBN:978-5-532-11043-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Бетенеков - Избранные главы курса Радиохимия краткое содержание
Избранные главы курса Радиохимия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
3. Ионы переходных металлов с частично заполненными d -орбиталями. В зависимости от числа d -электронов свойства этих ионов в большей или меньшей степени напоминают свойства ионов предыдущих групп. Устойчивость комплексов ионов этой группы зависит от z и r и от стабилизации, обусловленной расщеплением d -орбиталей. Устойчивость комплексов с однотипными лигандами обычно возрастает с увеличением степени окисления иона металла. Гексацианоферрат (III) более устойчив, чем аналогичный по строению гексацианоферрат (II). Устойчивость комплексов с азот и кислород содержащими лигандами изменяется в ряду: Mn < Fe < Co < Ni < Cu > Zn. От Mn к Zn уменьшается ионный радиус и от Fe к Cu повышается энергия стабилизации кристаллического поля. В случае Zn d -орбитали полностью заполнены, так что при образовании комплексов они не стабилизируются. Именно по этому порядок последовательности изменяется после Cu.
Если реакцию комплексообразования рассматривать как реакцию кислот и оснований Льюиса, то по Пирсону ионы металлов 1 группы представляют собой жесткие кислоты, характеризующиеся низкой поляризуемостью и образующие устойчивые комплексные соединения с жесткими основаниями. Ионы второй группы – мягкие кислоты, образующие устойчивые комплексные соединения с мягкими основаниями. Свойства ионов металлов третьей группы занимают промежуточное положение между свойствами ионов металлов 1 и 2 групп.
Устойчивость комплексов, прежде всего, определяется природой донорного атома лиганда. В роли донорных атомов лигандов могут выступать следующие элементы, расположенные в последовательности повышения электроотрицательности:
As, P < C, Se, S, I < Br < N, Cl < O
Ионы металлов 1 группы (жесткие кислоты по Пирсону) предпочтительно взаимодействуют с донорными атомами правой части ряда, а ионы металла 2 группы (мягкие кислоты по Пирсону) – с донорными атомами левой части ряда.
Наиболее устойчивые комплексные соединения образуются с хелатообразующими лигандами.
Внутрикомплексные соединения
Катионы металлов имеют несколько вакантных орбиталей для образования связи с лигандами, например, Zn имеет 4 таких орбитали. Однако, такие лиганды, как хлорид, бромид, цианид, аммиак могут занимать только одно координационное место. Каждый и этих лигандов отдает одну неподеленную пару электронов центральному атому. Такие лиганды называются монодентатными ( dentatus – зубчатый). Следовательно, количество лигандов будет соответствовать координационному числу.
Существуют лиганды, которые называются полидентатными, которые могут предоставить две или более электронных пар центральному атому для образования комплекса. Комплекс, состоящий из центрального атома и одного или нескольких полидентатных лигандов, называется хелатным соединением или хелатом. В некотором смысле две или более электродонорных групп каждого лиганда действуют как клешни, захватывающие центральный атом при образовании связи с ним. Таким образом, полифункциональные молекулы или ионы могут присоединяться к центральному атому металла более, чем одним атомом группы. Термин «хелат» первоначально использовали для обозначения бидентатного характера группы, но впоследствии он был перенесен на все полидентатаные лиганды, и стал применяться, как для названия хелатной группы, так и для комплекса в целом.
Примеры лигандов различной дентатности.
1. Монодентатные лиганды: H 2O, NH 3, Cl -, CN -…
2. Бидентатные лиганды: SO 4 2-, CO 3 2-, C 2O 4 2-, NH 2– C 2H 4– NH 2(этилендиамин).
3. Тридентатные лиганды: диацетоамин
и далее вплоть до октадентатных.
Для бидентатных лигандов типа SO 4 2-, CO 3 2-, C 2O 4 2-возможно образование равноценных связей с образованием циклов. Причем связи в этом случае пространственно и энергетически симметричны.
Другой большой класс соединений в которых образуются в частности четырехчленные циклы составляют мостиковые комплексы. В этом случае донорный атом связывает два иона металла и его называют мостиковой группой:
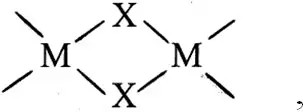
где X ≡ OH -, NH 2 -, Cl -.
Среди факторов, которые влияют на устойчивость комплексов, необходимо отметить следующие:
1. дентатность лиганда: комплексы с полидентатными лигандами более устойчивы, чем с монодентатными;
2. размер хелатного цикла: наибольшей устойчивостью обладают пяти– и шестичленные циклы;
3. пространственные факторы;
4. резонансные эффекты.
Количественную оценку образующихся комплексных соединений можно сделать сравнивая их константы устойчивости. Рассмотрим устойчивость комплексных соединений меди с лигандами различной дентатности, включающие в состав аминные группы:

Увеличение устойчивости комплекса с увеличением дентатности лиганда называют хелатным эффектом ХЭ: 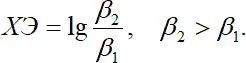 (1.15)
(1.15)
Рассмотрим образование комплексов меди с аммиаком и этилендиамином (NH 2C 2H 4NH 2, введем обозначение en):
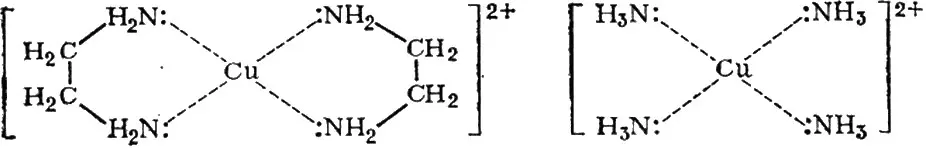
[Cu(H 2O) 4] 2++ 4NH 3↔ [Cu(NH 3) 4] 2++ 4H 2O (1)
[Cu(H 2O) 4] 2++ 2 en ↔ [Cu( en ) 2] 2++ 4H 2O (2)
Устойчивость комплексного соединения симбатна количеству образующихся циклов. Играет роль энергетика и пространственная организация связи.
Энергия Гиббса 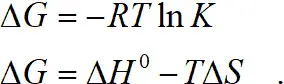
Теплота образования ΔH практически одинакова при образовании связи, как для аммиака, так и для этилендиамина, т. к. в обоих случаях образуется связь через азот. Поэтому энтальпийная составляющая отличается незначительно. Следовательно, дело в энтропийном факторе, который характеризуется изменением числа степеней свободы системы:

Таким образом, во второй реакции наблюдается увеличение числа частиц в системе, рост энтропии, что приводит к росту устойчивости данного соединения и выражается в конечном счете хелатным эффектом.
Более того, существует выигрыш в кинетике процесса. Рассмотрим две реакции с участием в качестве лигандов аммиака и этилендиамина.
M + 2NH 3↔ M (NH 3) 2(1)
M + en ↔ M ( en ) (2)
Если рассматривать механизм, учитывая ступенчатое комплексообразование, то образование соединений по обеим реакциям происходит в две стадии:
Читать дальшеИнтервал:
Закладка:










