Алексей Сизенцов - Антибиотики и химиотерапевтические препараты
- Название:Антибиотики и химиотерапевтические препараты
- Автор:
- Жанр:
- Издательство:Литагент БИБКОМ
- Год:2012
- Город:Оренбург
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Алексей Сизенцов - Антибиотики и химиотерапевтические препараты краткое содержание
Антибиотики и химиотерапевтические препараты - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Известно, что микроорганизмы и в особенности актиномицеты легко изменяются при обычных методах их хранения. Причем довольно часто при этом наблюдается полная или частичная потеря антибиотических свойств.
Потеря антибиотических свойств зависит, по-видимому, от того, что мы не умеем в обычных условиях культивирования создать такие условия, которые бы способствовали сохранению организмом его основных физиологических особенностей. Нередко потеря активности наблюдается при культивировании микроорганизмов на богатых по составу средах и при частых пересевах.
Вместе с тем изменение физиологических или биохимических свойств продуцентов антибиотических веществ может определяться их генетическими закономерностями. Известно, например, что продуцент грамицидина С в процессе развития диссоциирует на ряд вариантов, некоторые из которых не образуют этот антибиотик. Причем процесс диссоциации культуры идет в направлении образования в большом количестве биологически неактивных вариантов, что в конечном итоге приводит к полной потере культурой способности образования грамицидина С.
В настоящее время используется ряд методов сохранения культур продуцентов антибиотиков, обеспечивающий их длительное пребывание в активном состоянии. В основу этих методов положен принцип задержки развития микроорганизмов (принцип консервации). Для каждого вида продуцента антибиотических веществ должен быть подобран свой, наиболее подходящий метод консервирования, позволяющий сохранить культуры в активном состоянии в течение относительно длительного времени.
Наиболее распространенными методами сохранения культур микроорганизмов-продуцентов антибиотиков в активном состоянии являются следующие:
1) лиофилизация культур;
2) хранение вегетативных клеток или спор организмов в стерильной почве, стерильном песке или на семенах некоторых растений (например, просе). По данным ряда авторов, культуры актиномицетов, находящихся в стерильной почве, сохраняют жизнеспособность в течение 30 лет и более;
3) хранение спор в виде водных суспензий в запаянных ампулах;
4) хранение спор в стерильном кварцевом песке;
5) хранение культур на агаровом косячке под минеральным маслом;
6) хранение культур при низких температурах (4, 5 °С);
7) в последнее время для сохранения различных микроорганизмов в активном состоянии используют жидкий азот, в который помещают отмытую от среды суспензию клеток. Иногда в газообразной фазе жидкого азота сохраняют культуры актиномицетов, находящиеся на агаровых блочках, вырезанных из агаровой пластинки в чашках Петри.
Наилучшей формой сохранения организмов, при которой не наблюдается потери антибиотической активности, является их лиофилизация, данный метод пригоден как для спорообразующих, так и для бесспоровых культур микроорганизмов. Сущность этого метода состоит в том, что суспензия клеток или спор микроорганизма, приготовленная на среде богатой белками (часто используется для этих целей кровяная сыворотка), быстро замораживается при температуре от минус 40 °С до минус 60 °C и высушивается под вакуумом до остаточной влажности (от 0,5 % до 0,7 %). После такой обработки ампулы со спорами или клетками лиофилизированного микроба запаивают. Лиофилизированные формы бактерий могут сохраняться в течение 16-18 лет, споры грибов не теряют основных свойств при хранении их в лиофилизированном виде в течение 10 лет.
3.7 Определение антибиотической активности микроорганизмов
После того как микроб-антагонист выделен из естественного субстрата, его антибиотическую активность по отношению к различным тест-объектам определяют одним из существующих методов. При этом важно учитывать те факторы, которые влияют на образование антибиотиков. Изучение антибиотических свойств микроорганизмов осуществляют при их культивировании на твердых (агаризированных) или в жидких средах.
3.7.1 Методы определения антибиотической активности микроорганизмов, выросших на твердых питательных средах
Большинство методов определения антибиотической активности связано с культивированием изучаемого организма на агаризированных средах. Здесь мы остановимся лишь на наиболее распространенных методах выявления антибиотических свойств микробов.
Метод перпендикулярных штрихов . Испытуемый организм высевается штрихом (полоской) на поверхность агаровой пластинки чашки Петри. После того как микроорганизм разовьется, перпендикулярно его штриху подсеваются различные тест-организмы. Чашки помещаются в термостат на 20-24 ч. Если изучаемый организм оказывает антимикробное действие в отношении ряда тест-микробов, то последние будут расти вдали от штриха антагониста. Нечувствительные микробы будут развиваться в непосредственной близости от штриха изучаемого организма (рисунок 4).
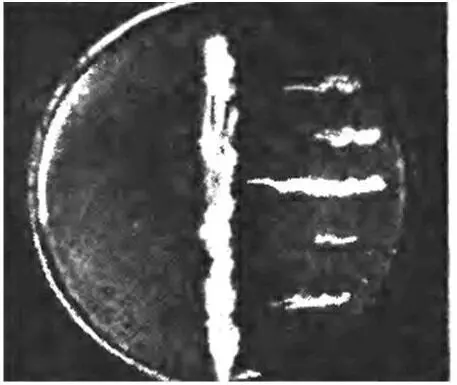
Рисунок 4 – Метод перпендикулярных штрихов для определения антагонистических свойств микроорганизмов
Данный метод используется в практике поиска продуцентов антибиотических веществ, однако он имеет один существенный недостаток. При методе штриха используется одна и та же среда для культивирования изучаемого организма и для роста тест-микробов.
Например, если для образования антибиотика необходима среда с нитратным источником азота, то такая среда может быть совершенно непригодной для развития ряда тест-организмов. И наоборот, многие тест-организмы хорошо растут на среде, состоящей из бульона Хоттингера, но не все организмы могут продуцировать антибиотик на этой среде. В этом случае можно не определить антибиотическую активность организма, хотя он и обладает этой способностью.
Метод агаровых блочков. Изучаемый организм высевают сплошным «газоном» на поверхность агаровой пластинки в чашке Петри. Среда используется такая, которая благоприятна не только для роста организма, но, самое главное, для образования им антибиотика. Иногда целесообразно высевать организм на разные по составу среды.
После того как организм хорошо вырастет, пробочным сверлом (диаметр примерно 8 мм) вырезают агаровые блочки, которые переносят на поверхность другой агаровой пластинки, предварительно засеянной одним тест-организмом. На одну чашку Петри можно разместить 5-7 агаровых блочков (рисунок 5).
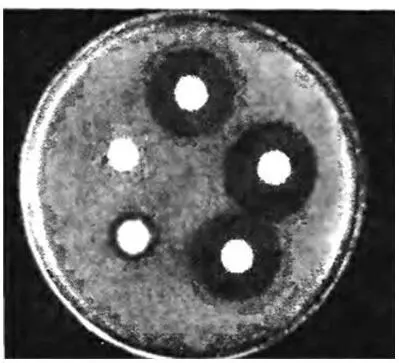
Рисунок 5 – Использование агаровых блочков с выросшей культурой микроба для определения ее антибиотических свойств
Читать дальшеИнтервал:
Закладка:










