Санджай Прадхана - Многоликая коррупция. Выявление уязвимых мест на уровне секторов экономики и государственного управления
- Название:Многоликая коррупция. Выявление уязвимых мест на уровне секторов экономики и государственного управления
- Автор:
- Жанр:
- Издательство:Array Литагент «Альпина»
- Год:2010
- Город:Москва
- ISBN:978-5-9614-2185-9
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Санджай Прадхана - Многоликая коррупция. Выявление уязвимых мест на уровне секторов экономики и государственного управления краткое содержание
Многоликая коррупция. Выявление уязвимых мест на уровне секторов экономики и государственного управления - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Коррупцию можно минимизировать, если институты прозрачны, интерес общественности высок, а правовые и административные процессы требуют от чиновников отчета о своих действиях (Swenke, 2002). Приведенный здесь анализ построен на рекомендации Клитгарда разделить коррупцию на типы, определить масштаб и серьезность каждого типа и выявить тех, кто выигрывает и проигрывает от коррупции.
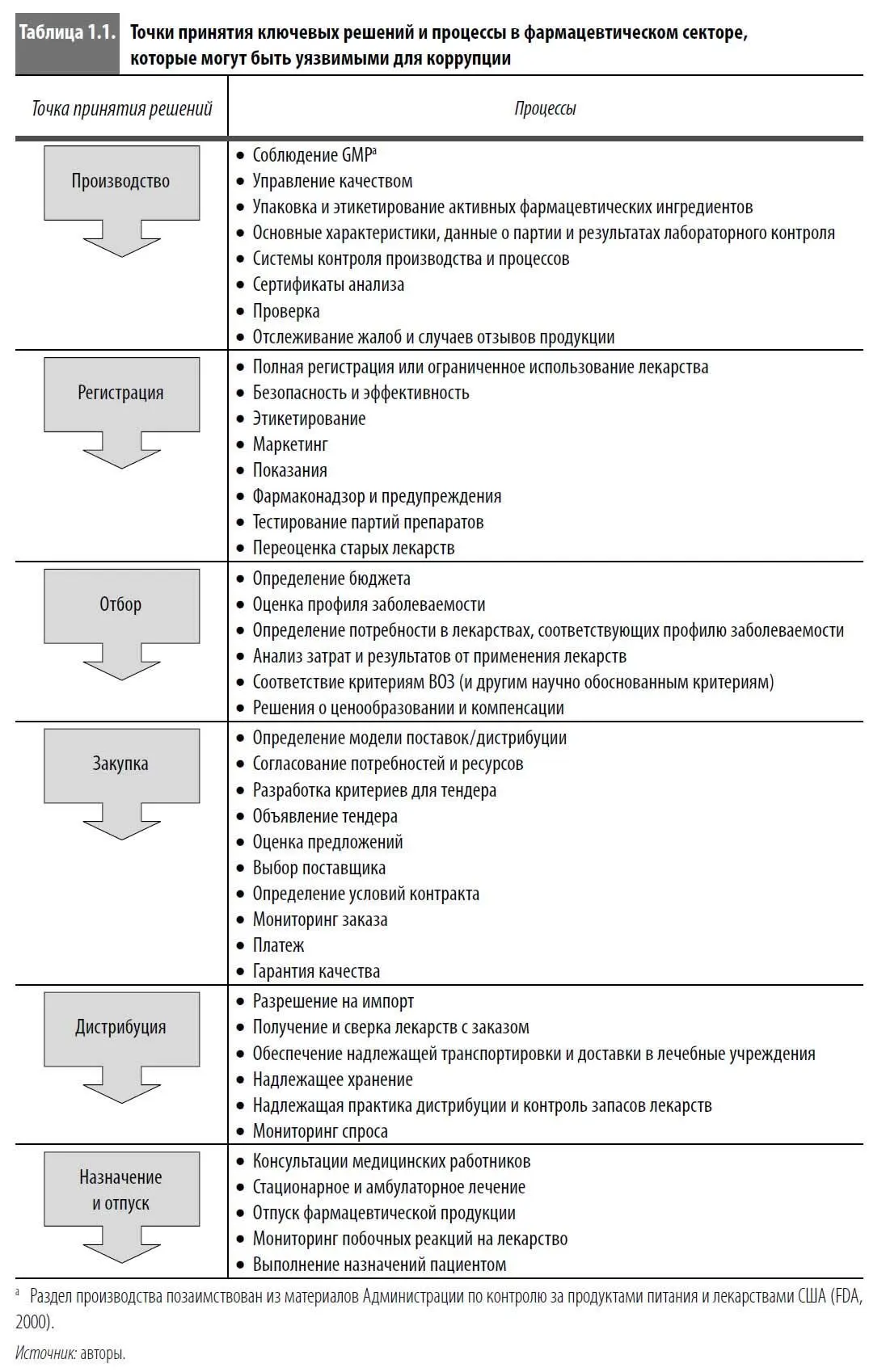
Анатомия коррупции: шесть точек принятия ключевых решений
Шесть основных областей фармацевтического сектора являются точками принятия ключевых решений и главными мишенями для коррупции: производство, регистрация, отбор, закупка, дистрибуция, назначение и отпуск (табл. 1.1). Основные цели этого раздела – обозначить области, в которых может появиться монополия и свобода действий, и познакомить со стратегиями, которые помогают повысить прозрачность и подотчетность в системе. Эта система координат соответствует недавней работе ВОЗ на тему прозрачности в фармацевтическом секторе (Baghdadi, Cohen, and Wondemagegnehu, 2005).
Точка принятия решений 1: производство
Производство фармацевтической продукции требует строгого соблюдения стандартов надлежащей практики организации производства (good manufacturing practice – GMP) для того, чтобы «продукты производились и контролировались в соответствии со стандартами качества, отвечающими предполагаемому использованию и требованиям регистрационного удостоверения» (WHO, 2003). GMP – термин, определение которого имеется в законах многих стран, он описывает набор принципов и процедур обеспечения качества, которые необходимо соблюдать производителям лекарственных средств для получения продукции соответствующего качества. По данным ВОЗ, соблюдение GMP помогает снизить риски, свойственные фармацевтической продукции, в частности риск перекрестного загрязнения (в том числе непредвиденными контаминантами) и путаницы, вызванной, например, наклеиванием на контейнеры не тех этикеток. Если эти стандарты не выполняются по всему производственному процессу, включая работу с сырьем, хранение, упаковку и этикетирование, появляется риск производства некачественных лекарств. Там, где такие стандарты четко не определены, несовершенны или плохо исполняются, риск попадания в обращение фальсифицированных или не соответствующих стандартам лекарств повышается.
Поддельными или фальсифицированными называют лекарства, намеренно изготовленные так, чтобы выглядеть как оригинальный продукт, и, следовательно, нарушающие права на торговую марку или патенты. Рынок фальсифицированных лекарств растет по всему миру. По прогнозам Центра лекарств в общественных интересах, к 2010 г. мировой рынок фальсифицированных лекарств вырастет более чем на 90 % и годовой объем продаж достигнет $75 млрд (Pitts, 2005). В США и Европе производству фальсифицированных лекарств способствует их продажа через Интернет. Такие продажи обходят стандартные системы надзора и неэффективно контролируются (Satchwell, 2004). Хотя фальсифицированные лекарства внешне зачастую невозможно отличить от настоящих, они могут не оказывать нужного клинического воздействия и даже быть небезопасными для здоровья в результате недостаточного количества активных фармацевтических ингредиентов или их отсутствия.
Не соответствующие стандартам или фальсифицированные лекарства могут привести к ухудшению здоровья, а иногда и к смерти. Один из наиболее трагических случаев произошел в 1995 г. на Гаити, где 89 человек умерло после употребления сиропа от кашля с парацетамолом, изготовленного с применением диэтиленгликоля – токсичного вещества, применяемого в качестве антифриза. Особое беспокойство вызывают не соответствующие стандартам антибиотики и противомалярийные средства с пониженным содержанием активного вещества, поскольку возбудители болезни могут быстрее выработать устойчивость к ним. Одно из исследований, проведенных в Юго-Восточной Азии, показало, что 38 % лекарств, продаваемых под видом противомалярийного средства на основе артезуната, не содержали достаточного количества действующего вещества или не содержали его совсем, что потенциально усиливает устойчивость возбудителя (Newton and others, 2001). Беспокойство, вызванное растущей устойчивостью возбудителей к противомалярийным средствам в районе реки Меконг в Азии, вынудило правительства активизировать деятельность, направленную на выявление фальсифицированных лекарств и уменьшение уровня сопротивляемости малярийного паразита (пример 1.2). Фальсифицированные и не соответствующие стандартам лекарства также наносят ущерб рынку законно произведенных качественных лекарств, уменьшая их конкурентоспособность на поле с равными условиями.
В 2003 г. программа фармакопеи США «Качество лекарств и информация», Агентство международного развития, ВОЗ, а также государственные и местные власти азиатских стран начали мониторинг качества противомалярийных средств, используемых в районе реки Меконг (Камбоджа, Лаосская Народно-Демократическая Республика, Таиланд, Вьетнам и китайская провинция Юньнань), и обучение персонала на местах навыкам тестирования лекарств. В течение первого года качество распространяемых противомалярийных лекарств (артезунат, хинин, хлорохин, сульфадоксин-пираметамин) проверялось с помощью основных тестов: визуального осмотра, растворения и тонкослойной хроматографии. В результате анализа фальсифицированные или не соответствующие стандартам противомалярийные лекарства были обнаружены во всех странах. По меньшей мере в двух странах 50 % исследованных образцов не имели информации о производителе или сроке годности. Органы контроля за лекарственными средствами во всех перечисленных странах предприняли меры по решению этих проблем. В частности, была улучшена коммуникация между региональными системами мониторинга, с одной стороны, и местными и государственными властями – с другой, что позволило быстрее оповещать о появлении поддельных лекарств и изымать их из аптек.
Источник: U.S. Pharmacopeial Convention Inc. (2005).Для более строго соблюдения требований GMP можно предпринять несколько шагов. Во-первых, стандарты GMP должны быть кодифицированы, а последствия их невыполнения установлены в законодательном порядке. Во многих странах до сих пор отсутствует юридическое определение или обязательность применения GMP. Во-вторых, можно принять международные стандарты GMP. В настоящее время требования GMP различаются в разных странах и даже в разных агентствах, следящих за их применением. Даже определения GMP, используемые ВОЗ, ЕС и Администрацией по контролю за продуктами питания и лекарствами США, в некоторой мере различны. Такие различия могут приводить к непредвиденным отрицательным последствиям (пример 1.3).
Читать дальшеИнтервал:
Закладка:








