БСЭ - Большая Советская энциклопедия (Но)
- Название:Большая Советская энциклопедия (Но)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ - Большая Советская энциклопедия (Но) краткое содержание
Большая Советская энциклопедия (Но) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
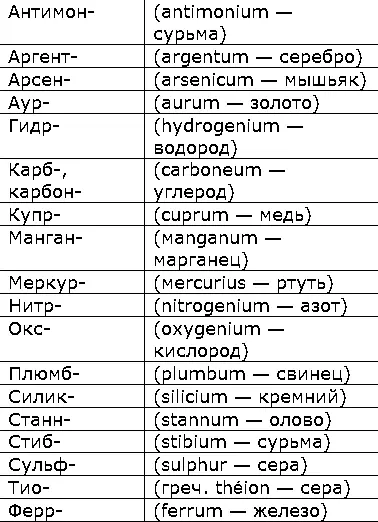
В Н. н. с. применяют корни главным образом латинских названий элементов, отличающиеся от русских (таблица 1).
Таблица 1.
Название радикалов (атомных групп, переходящих без изменений из одного соединения в другое) составляют из корней латинских названий элементов и суффикса — ил (от греч. hýlē — вещество). Примеры: гидроксил OH, карбонил CO. Исторические названия: аммоний NH 4, циан CN, родан CNS, амид NH 2сохраняются.
В названиях соединений, состоящих из атомов двух элементов с ионной или полярной ковалентной связью, на первое место ставится наименование более электроотрицательной части. По международной Н. н. с. (МН, в отличие от русской номенклатуры PH) оно составляется из корня латинского названия элемента и суффикса — ид (от греч. суффикса — idēs, означающего отчество в собственных именах). На второе место ставится название электроположительного элемента в родительном падеже (например, NaCI — хлорид натрия). Степень окисления электроположительного элемента указывают либо римской цифрой в скобках (что предпочтительнее), либо приставками, заимствованными из греческих количественных числительных: геми-(полу-), моно-(1), ди-(2), три-(3), тетра-(4), пента-(5), гекса-(6), гепта-(7), окто-(8), нона-(9), дека-(10). Примеры: FeCl 2— хлорид железа (II), дихлорид железа; FeCl 3— хлорид железа (III), трихлорид железа; Cu 2S — сульфид меди (I), гемисульфид меди, CuS — сульфид меди (II), моносульфид меди.
По PH вместо суффикса — ид применяют суффиксы — истый для указания либо единственной, либо низшей степени окисления и — ный (иногда — овый, — евый) для высшей степени окисления. Для обозначения степени окисления также пользуются русскими числительными и римскими цифрами. Примеры: NaCI — хлористый натрий; FeCI 2— хлористое железо, двухлористое железо, хлористое железо (II); FeCl 3— хлорное железо, трёххлористое железо, хлористое железо (III).
Соединения элементов с кислородом, в которых он связан только с более электроположительными атомами, называется по МН оксидами, по PH — окислами . В порядке возрастания степени окисления электроположительного элемента окислам либо дают названия закись, окись, двуокись, трёхокись, либо указывают римской цифрой степень окисления. Окислы, которые можно получить отнятием воды от кислот, называются ангидридами (МН отменяет этот термин). В табл. 2 сопоставлены названия окислов хрома по МН и PH.
Соединения, в которых атомы кислорода связаны и друг с другом, и с атомами более электроположительного элемента, называются пероксидами или перекисями (см. Перекисные соединения ). Примеры: пероксид (перекись) водорода Н — О — О — Н, пероксид бария.
Соединения неметаллов с водородом, водные растворы которых имеют характер кислот, называются сочетанием корня русского названия элемента и слова водород, например HCl — хлороводород, H 2S — сероводород. Названия прочих простейших соединений неметаллов с водородом (вода H 2O, аммиак NH 3, фосфин PH 3, арсин AsH 3, метан CH 4, силан SiH 4, боран BH 3) сохраняются. Соединения водорода с металлами называются гидридами, например гидрид лития LiH, гидрид (дигидрид) кальция СаН 2, иногда — водородистыми металлами.
Таблица 2.

*От лат. sesqui — полтора.
По PH названию кислородных кислот составляют из корня русского названия кислотообразующего элемента и суффиксов — ная, — овая (для высшей степени окисления), — истая, — оватая, — оватистая (для низших степеней окисления в убывающем порядке). Примеры: HClO 4— хлорная кислота, HClO 3— хлорноватая кислота, HClO 2— хлористая кислота, HOCl — хлорноватистая кислота. Кислоты, образованные элементом одной и той же степени окисления, но содержащие неодинаковое число молекул воды, различаются приставками орто- (греч. orthós — прямой) для кислоты с наибольшим содержанием воды и мета- (греч. metá — после) — с наименьшим. Примеры: H 3PO 4— фосфорная ортокислота; HPO 3— фосфорная метакислота. Кислоты, содержащие свыше одного атома кислотообразующего элемента в одной и той же степени окисления, называются изополикислотами; число атомов этого элемента указывают русской (иногда греческой) приставкой. Примеры: H 2S 2O 7— двусерная кислота, H 2Cr 3O 10— трихромовая кислота, H 2B 4O 7— четырёхборная (тетраборная) кислота. Название «пирокислота» выходит из употребления.
Основания называются по МН гидроксидами, по PH — гидроокисями. Если металл образует свыше одного основания, степень окисления металла указывают либо римской цифрой в скобках, либо приставкой — русской или греческой. Примеры: Fe (OH) 2— гидроксид железа (II), дигидроксид железа, двугидроокись железа; Fe(OH) 3— гидроксид железа (III), тригидроксид железа; трёхгидроокись железа. Название «гидрат закиси», «гидрат окиси» выходят из употребления.
Названия солей по МН составляются из названий аниона в именительном падеже и катиона в родительном падеже. Название анионов кислородных кислот составляют из корня латинского названия кислотообразующего элемента и суффиксов: — ат для высшей степени окисления и — ит — для низшей. Примеры: SO 2- 4 —сульфат-ион, K 2SO 4сульфат калия; SO 2- 3— сульфит-ион, Na 2SO 3— сульфит натрия. Если число кислот, образуемых элементом в различных степенях окисления, больше двух, то название аниона, в котором эта степень наивысшая, имеет суффикс — ат и приставку пер- (лат. приставка per означает усиление); следующие степени окисления в убывающем порядке указываются суффиксами — ат, — ит и, наконец, — ит и приставкой гипо- (греческая приставка hýpo означает ослабление качества). Примеры:
ClO - 4— перхлорат-ион, ClO - 3— хлорат-ион, ClO 2— хлорит-ион, ClO -— гипохлорит-ион. В названиях солей степень окисления катиона указывают римскими цифрами в скобках: FeSO 4— сульфат железа (II), Fe 2(SO 4) 3— сульфат железа (III). В названиях анионов орто-и метакислот включают эти обе приставки; PO 3- 4— ортофосфат-ион, PO 3-— метафосфат-ион. Названия анионов кислых солей имеют приставку гидро-, например: HSO - 4— гидросульфат-ион, H 2PO - 4— дигидроортофосфат-ион. Названия катионов основных солей имеют приставку гидроксо- [напр.: MgOH +— гидроксомагний-ион, Bi (OH) + 2— дигидроксовисмут (III) — ион] или okco-[VO +— оксованадий (III) — ион]. Нередко применяют нерекомендуемые названия солей, такие, как NaHCO 3— бикарбонат (надо гидрокарбонат) натрия, K 2S 2O 7— бихромат (надо дихромат) калия, K 2S 2O 5— метабисульфит (надо дисульфит) калия, а также старинные наименования: квасцы, купоросы, селитры .
Лит.: Лучинский Г. П., Номенклатура неорганических соединений, в кн.: Краткая химическая энциклопедия, т. 3, М., 1964; Материалы к проекту номенклатуры неорганических соединений, М., 1968; Некрасов Б. В., Основы общей химии, 2 изд., т. 1, М., 1969; Лабораторный практикум по общей химии, под ред. С. Л. Погодина, 2 изд., М., 1972, с. 27–33; Бусев А. И., Ефимов И. П., Словарь химических терминов. Пособие для учащихся, М., 1971; Nomenclature of inorganic chemistry. Definitive rules for nomenclature of inorganic chemistry, L., 1959; Crosland М. P., Historical studies in the language of chemistry, L., 1962.
Читать дальшеИнтервал:
Закладка:










