БСЭ - Большая Советская энциклопедия (На)
- Название:Большая Советская энциклопедия (На)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ - Большая Советская энциклопедия (На) краткое содержание
Большая Советская энциклопедия (На) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Вследствие большой химической активности Н. обращение с ним требует осторожности. Особенно опасно попадание на Н. воды, которое может привести к пожару и взрыву. Глаза должны быть защищены очками, руки — толстыми резиновыми перчатками; соприкосновение Н. с влажной кожей или одеждой может вызвать тяжёлые ожоги.
В. Е. Плющев.
Натрий в организме. Н. — один из основных элементов, участвующих в минеральном обмене животных и человека. Содержится главным образом во внеклеточных жидкостях (в эритроцитах человека около 10 ммоль / кг , в сыворотке крови 143 ммоль / кг ); участвует в поддержании осмотического давления и кислотно-щелочного равновесия , в проведении нервных импульсов (см. Мембранная теория возбуждения ). Суточная потребность человека в хлористом натрии колеблется от 2 до 10 г и зависит от количества этой соли, теряемой с потом. Концентрация ионов Н. в организме регулируется в основном гормоном коры надпочечников — альдостероном . Несмотря на относительно высокое содержание Н. в тканях растений (около 0,01% на сырую массу), его роль в жизни растений изучена недостаточно. У галофитов (виды, произрастающие на сильно засоленных почвах) Н. создаёт высокое осмотическое давление в клеточном соке и тем самым способствует извлечению воды из почвы. См. также Водно-солевой обмен .
И. Ф. Грибовская.
В медицине из препаратов Н. наиболее часто применяют натрия сульфат , хлорид NaCI (при кровопотерях, потерях жидкости, рвоте и т.п.), борат Na 2B 4O 7×10H 2O (как антисептическое средство), гидрокарбонат NaHCO 3(как отхаркивающее средство, а также для промываний и полосканий при ринитах, ларингитах и др.), тиосульфат Na 2S 2O 3×5H 2O (противовоспалительное, десенсибилизирующее и противотоксическое средство) и цитрат Na 3C 6H 5O 7×5 1/ 2H 2O (препарат из группы антикоагулянтов ).
Искусственно полученные радиоактивные изотопы 22Na (период полураспада T 1/2= 2,64 г.) и 24Na ( T 1/2= 15 ч ) применяют для определения скорости кровотока в отдельных участках кровеносной системы при сердечно-сосудистых и лёгочных заболеваниях, облитерирующем эндартериите и др. Радиоактивные растворы солей Н. (например, 24NaCI) используют также для определения сосудистой проницаемости, изучения общего содержания обменного Н. в организме, водно-солевого обмена, всасывания из кишечника, процессов нервной деятельности и в некоторых др. экспериментальных исследованиях.
М. Д. Дорфман.
Лит.: Ситтиг М., Натрий, его производство, свойства и применение, пер. с англ., М., 1961; Ullmanns Encykiopädie der technihen Chemie, 3 Aufl., Bd 12, Münch. — B., 1960: Реформатский И. А., Натрий, в кн.: Краткая химическая энциклопедия, т. 3, М., 1964; Рипан Р., Четяну И., Неорганическая химия, т. 1, пер. с рум., М., 1971; Проссер Л., Браун Ф., Сравнительная физиология животных, пер. с англ., М., 1967.
Натрия бикарбонат
На'трия бикарбона'т,натрия гидрокарбонат, двууглекислый натрий, NaHCO 3, пищевая (или питьевая) сода .
Натрия бромид
На'трия броми'д,бромистый натрий, NaBr, соль; бесцветные кристаллы, плотность 3,20 г / см 3, t пл760 °С. Растворимость в воде (%): 48,6 (25 °С), 54,8 (100 °С); из водных растворов при обычной температуре кристаллизуется NaBr×2H 2O. Получают NaBr действием брома на растворы NaOH в присутствии восстановителей, либо обменной реакцией между Fe 3Br 8и Na 2CO 3. Применяют в производстве светочувствительных фотоматериалов (бромосеребряных плёнок и бумаги) и в медицине (успокаивающее и снотворное).
Натрия гидроокись
На'трия гидроо'кись,едкий натр, каустическая сода, NaOH, едкая щёлочь; бесцветные кристаллы, плотность 2,13 г / см 3, t пл320 °С.
Технический продукт — белая твёрдая непрозрачная масса с лучистым изломом. Н. г. гигроскопична, при её соединении с водой выделяется большое количество тепла. Водные растворы имеют сильную щелочную реакцию. Растворимость в воде (%): 52,2 (20 °С), 75,8 (80 °С). Образует кристаллогидраты, из которых при обычной температуре устойчив NaOH×Н 2О (12,3—61,8 °С). На воздухе NaOH, поглощая CO 2, превращается в натрия карбонат . NaOH разрушает кожу, бумагу и др. Особенно опасно попадание даже малейших её количеств в глаза. Получают NaOH электролизом растворов NaCI или кипячением раствора Na 2CO 3с известковым молоком:
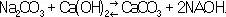
Раствор Н. г. выпаривают, остаток нагревают до плавления и отливают в формы. При электролизе одновременно получается хлор . Н. г. — один из основных продуктов химической промышленности; широко применяется как в самой химической промышленности, так и во многих др. производствах. См. также Калия гидроокись .
Натрия иодид
На'трия иоди'д,иодистый натрий, Nal, соль; бесцветные кристаллы, плотность 3,665 г / см 3 , t nл662 °С. При хранении на свету желтеет вследствие окисления кислородом воздуха с выделением свободного йода. Гигроскопичен; растворимость в воде (%): 64,1 (20 °С), 75,1 (100 °С). Из водных растворов при обычной температуре кристаллизуется Nal×2H 2O. Получают Nal по обменной реакции между Fe 3I 8и Na 2CO 3; применяют в медицине как препарат йода.
Натрия карбонат
На'трия карбона'т,углекислый натрий, Na 2CO 3, кальцинированная сода .
Натрия нитрат
На'трия нитра'т,NaNO 3, то же, что натриевая селитра .
Натрия нитрит
На'трия нитри'т,азотистокислый натрий, NaNO 2, соль; бесцветные или слегка желтоватые кристаллы, плотность 2,17 г/см 3, t пл 271 °С. Растворимость в воде (%): 45,07 (22 °С), 61,5 (99,9 °С); водные растворы имеют щелочную реакцию. Кислотами NaNO 2разлагается с выделением окислов азота. Получают NaNO 2при поглощении окислов азота щелочными растворами с последующим их упариванием. При охлаждении NaNO 2кристаллизуется. Н. н. применяют в реакциях диазотирования при производстве азокрасителей , как окислитель при выделении иода из иодидов, при изготовлении колбас для сохранения красного цвета мяса, в медицине как сосудорасширяющее средство.
Натрия перекись
На'трия пе'рекись,Na 2O 2, см. Перекись натрия .
Натрия силикаты
На'трия силика'ты,натриевые соли кремниевых кислот, например Na 2SiO 3; см. Силикаты натрия .
Натрия сульфат
На'трия сульфа'т,сернокислый натрий, Na 2SO 4, соль; бесцветные кристаллы. Встречается в природе в виде минерала тенардита ; плотность 2,698 г/см 3, t пл 884 °С. Растворимость в воде (%): 16,3 (20 °С), 29,8 (100 °C). Безводный Na 2SO 4устойчив выше температуры 32,384 °С, ниже этой температуры кристаллизуется Na 2SO 4×10H 2O. В природе этот кристаллогидрат образует минерал мирабилит (глауберову соль). Встречаются также двойные соли Н. с. с др. сульфатами, например астраханит Na 2SO 4×MgSO 4×4H 2O, глауберит Na 2SO 4×CaSO 4. Значительные количества Н. с. содержатся рапе и донных отложениях солёных озёр хлорид-сульфатного типа и заливе Кара-Богаз-Гол . В них при понижении температуры идёт реакция
Читать дальшеИнтервал:
Закладка:










