БСЭ - Большая Советская энциклопедия (На)
- Название:Большая Советская энциклопедия (На)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ - Большая Советская энциклопедия (На) краткое содержание
Большая Советская энциклопедия (На) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
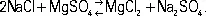
Н. с. кристаллизуется в виде мирабилита. Др. способ получения Н. с. — взаимодействие NaCI с H 2SO 4в специальных «сульфатных» печах при 500—550 °С; одновременно получается соляная кислота . Н. с. применяют в стекольном производстве, при получении сульфатной целлюлозы, в текстильной, мыловаренной, кожевенной промышленности и в цветной металлургии, а также в медицине и ветеринарии (как слабительное средство).
Натрия гидросульфат NaHSO 4и натрия дисульфат (пиросульфат) N 2S 2O 7применяются подобно KHSO 4и K 2S 2O 7(см. Калия сульфат ) .
Натрия сульфид
На'трия сульфи'д,сернистый натрий, Na 2S, соль; бесцветные кристаллы, плотность 1,856 г/см 3 , t пл 1180 °С. Сильно гигроскопичен; растворимость в воде (%): 13,6 (20 °С), 45,0 (97,5 °С); образует кристаллогидраты. Водные растворы Н. с. имеют щелочную реакцию. Na 2S получают восстановлением Na 2SO 4. Применяют при получении сернистых красителей, в текстильной и кожевенной промышленности, при флотации руд. Натрия гидросульфид NaHS применяют в производстве искусственного шёлка, в кожевенной промышленности и др. См. также Полисульфиды .
Натрия сульфит
На'трия сульфи'т,сернисто-кислый натрий, Na 2SO 3, соль; бесцветные кристаллы, плотность 2,63 г/см 3. Растворимость в воде (%): 20,82 (19,9 °С), 21,70 (99 °С). При обычной температуре из водных растворов кристаллизуется Na 2SO 3×7H 2O. Н. с. — сильный восстановитель; в водных растворах легко окисляется кислородом воздуха. В водных растворах Na 2SO 3присоединяет при нагревании серу с образованием тиосульфата натрия . Получают Н. с. взаимодействием растворов Na 2CO 3с SO 2. Входит в состав фотографических проявителей.
Натрия тиосульфат
На'трия тиосульфа'т,Na 2S 2O 3, см. Тиосульфат натрия , Тиосульфаты .
Натрия фосфаты
На'трия фосфа'ты,натриевые соли фосфорных кислот, например Na 3PO 4; см. Фосфаты , Фосфаты натрия .
Натрия фторид
На'трия фтори'д,фтористый натрий, NaF, соль; бесцветные кристаллы, плотность 2,79 г/см 3 , t пл 992 °С. Растворимость в воде (%): 3,90 (20 °С), 4,83 (100 °С). В природе Н. ф. встречается в виде минерала вильомита. В промышленности его получают спеканием плавикового шпата с содой и кремнезёмом (по реакции CaF 2+ Na 2CO 3+ SiO 2= 2NaF + CaSiO 3+ CO 2) и др. способами. Служит для консервирования древесины, иногда как инсектицид; входит в состав эмалей. Кислый Н. ф. — натрия гидрофторид NaHF 2, применяется как составная часть флюсов при пайке алюминия.
Натрия хлорид
На'трия хлори'д,хлористый натрий, поваренная соль, NaCI; бесцветные кристаллы, плотность 2,161 г/см 3, t пл 801 °С. Растворимость в воде (%): 26,28 (0 °С), 26,43 (25°C), 28,12 (100 °С); в присутствии др. солей растворимость Н. х. в воде сильно снижается. В природе Н. х. широко распространён в виде каменной соли (галита). Н. х. — важный пищевой продукт, служит также для консервирования мяса, рыбы и др., добавляется в корм скоту. Н. х. — один из главных видов химического сырья, идёт на получение едкого натра, хлора, соды, сульфата натрия и др. При дефиците NaCI в организме наблюдается сгущение крови, могут развиться спазмы гладкой мускулатуры, судорожные сокращения скелетных мышц, нарушения функций нервной системы и кровообращения. При некоторых заболеваниях (почек, гипертонической болезни) необходимо ограничить поступление NaCI в организм.
Изотонический раствор NaCI (0,9%) применяют для введения под кожу (внутривенно) и в виде клизм как дезинтоксикационное средство, для растворения лекарственных веществ и т.д.; гипертонический раствор (3—5—10%) — наружно в виде компрессов и примочек при лечении гнойных ран.
Натрия цианид
На'трия циани'д,цианистый натрий, NaCN, см. Цианид натрия , Цианиды .
Натролит
Натроли'т(от натрий и греч. lithos — камень), минерал из группы цеолитов . Химический состав Na 2[Al 2Si 3O 10]×2Н 2О. По типу кристаллохимической структуры относится к каркасным алюмосиликатам (см. Силикаты ) . Кристаллизуется в ромбической и тетрагональной системах. Встречается в виде удлинённо-призматических или игольчатых кристаллов, реже плотных скрытокристаллических масс. Обычно бесцветный либо слабо окрашен в сероватый или желтоватый цвета. Твердость по минералогической шкале 5—5,5; плотность 2200—2500 кг/м 3.
Кроме воды, Н. может поглощать NH 3, CO 2, H 2S и др. вещества. Обладает также способностью обменивать одни основания на другие. Это свойство широко используется в промышленности, главным образом при изготовлении пермутитов . Н. образуются путём осаждения из горячих водных растворов в пустотах и трещинах вулканических пород вместе с др. цеолитами, кальцитом, кварцем, хлоритами и др.; в результате гидротермального изменения нефелина, а также в зоне выветривания нефелиновых сиенитов и в современных морских отложениях.
М. Д. Дорфман.
Натрошвили Георгий Константинович
Натрошви'лиГеоргий Константинович [р. 10(23).1.1910, село Земо-Мачхаани, ныне Цителскаройского района], грузинский советский писатель, литературовед. Член КПСС с 1939. Окончил факультет языка и литературы Тбилисского университета (1933). Участник Великой Отечественной войны 1941—45. Печатается с 1930. Автор книг: «Творчество Давида Кладиашвили» (1935), «Александр Казбеги» (1949), «Давид Гурамишвили» (1955), «Георгий Леонидзе» (1958), «Слово о Бараташвили» (1968), сборников статей «Предки и современники» (1961) и «На грани двух веков» (1963). Успешно выступает как прозаик: сборники рассказов «На Западном фронте» (1943), «Весна стояла над Иори» (1957), «Смерть беззаботного человека» (1961, рус. пер. 1965) и др. Главный редактор грузинской «Литературной газеты» (1943—63), журнал «Дроша» («Знамя») — с 1963. Депутат Верховного Совета Грузинской ССР 8-го созыва. Награжден 4 орденами, а также медалями.
Соч. в рус. пер.: Рассказы, Тб., 1958.
Лит.: Блинкова М., Весь этот мир твой!, «Дружба народов», 1966, № 8.
Н. М. Микава.
Натрун
Натру'н,впадина на С.-В. Ливийской пустыни в Египте; см. Вади-Натрун .
Натта Джулио
На'тта(Natta) Джулио (р. 26.2.1903, Империя), итальянский химик-органик.
В 1924 окончил Миланский политехнический институт; с 1925 работал там же ассистентом. С 1927 профессор общей химии. В 1933—1935 директор института общей химии при университете в Павии. В 1935—37 декан физико-химического факультета Римского университета. С 1938 директор института промышленной химии при Миланском политехническом институте. Первые научные работы Н. были посвящены изучению структур твёрдых тел, в том числе структур катализаторов и некоторых органических полимеров. В 1938 начал исследования, связанные с производством синтетического каучука, и впервые осуществил разделение бутадиена и бутена-1. В 1954 открыл метод стереоспецифической полимеризации. В 1957 благодаря исследованиям Н. на промышленной установке получен изотактический полипропилен. Результатом других его работ явилось создание новых типов эластомеров. Вклад Н. и его школы в химию полимеров состоит в открытии нового класса полимеров с упорядоченной структурой — стереорегулярных полимеров . Нобелевская премия совместно с немецким химиком К. Циглером (1963). Иностранный член АН СССР (1966). Награжден золотой медалью им. М. В. Ломоносова (1970).
Читать дальшеИнтервал:
Закладка:










