БСЭ БСЭ - Большая Советская Энциклопедия (КР)
- Название:Большая Советская Энциклопедия (КР)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (КР) краткое содержание
Большая Советская Энциклопедия (КР) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Кристаллические структуры в К. делят на гомодесмические (координационные) и гетеродесмические. В первых все атомы объединены одинаковыми химическими связями, образующими пространственный каркас. Здесь нет группировок, которые можно было бы назвать молекулами. Гомодесмическую структуру имеют, например, алмаз, галогениды щелочных металлов. Однако гораздо чаще кристаллические вещества имеют гетеродесмическую структуру; её характерная черта — присутствие структурных фрагментов, внутри которых атомы соединены наиболее прочными (обычно ковалентными) связями. Эти фрагменты могут представлять собой конечные группировки атомов, цепи, слои, каркасы. Соответственно выделяются островные, цепочечные, слоистые и каркасные структуры. Островными структурами обладают почти все органические соединения и такие неорганические вещества, как галогены, O 2, N 2, CO 2, N 2O 4и др. Роль «островов» играют молекулы, поэтому такие кристаллы называются молекулярными. Часто в качестве «островов» выступают многоатомные ионы (например, сульфаты, нитраты, карбонаты). Цепочечное строение имеют, например, кристаллы одной из модификаций Se (атомы связаны в бесконечные спирали) или кристаллы PdCl 2, в которых присутствуют бесконечные ленты:
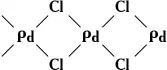
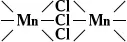
Слоистую структуру имеют графит, BN, MoS 2и др., каркасную структуру — CaTiO 3(атомы Ti и О, объединённые ковалентными связями, образуют ажурный каркас, в пустотах которого расположены атомы Ca). Известны гетеродесмические структуры, где имеются структурные фрагменты разного типа. Так, кристаллы комплексного соединения [N (CH 3) 4] [MnCI3] построены из «островов» — ионов [N (CH 3) 4] +и цепей
По характеру связи между атомами (в случае гомодесмических структур) или между структурными фрагментами (в случае гетеродесмических структур) различают: ковалентные (например, SiC, алмаз), ионные (см. Ионные кристаллы ), металлические (металлы и интерметаллические соединения) и молекулярные кристаллы. Кристаллы последней группы, в которой структурные фрагменты связаны межмолекулярным взаимодействием, имеют наибольшее число представителей. Сюда, в частности, входят кристаллы инертных газов. Деление кристаллов на указанные группы в значительной мере условно, поскольку существуют постепенные переходы от одной группы к другой. Однако типичные представители разных групп существенно различаются по свойствам, в частности, по величине энергии структуры (работы, необходимой для разъединения одного моля кристаллического вещества, взятого при атмосферном давлении и комнатной температуре, на отдельные атомы, ионы или молекулы).
Уменьшение Н соответствует уменьшению прочности связи. Резкое различие величины Н для Fe и Na объясняется тем, что в первом случае существенный вклад даёт ковалентное взаимодействие.
Значения энергии структуры Н для некоторых кристаллов с различными типами химической связи
| Тип кристалла | Вещество | Н, ккал/моль * |
| Ковалентный | SiC | 283 |
| Ионный | NaCi | 180 |
| Металлический | Fe Na | 94 |
| Молекулярный | CHi | 26 2,4 |
* 1 ккал/моль = 4,19 кдж/моль.
Кристаллохимический анализ строения вещества имеет два аспекта: стереохимический и кристаллоструктурный. В рамках первого обсуждаются величины кратчайших межатомных расстояний и значения валентных углов. При этом пользуются понятиями координационного числа (число ближайших соседей данного атома) и координационного многогранника. Для атомов многих элементов, склонных к ковалентному характеру связи, типичны определённые координационные числа и координационные многогранники, что обусловлено направленностью ковалентных связей. Так, атом Be, за редким исключением, имеет координационное число 4 (тетраэдр); для атома Cd характерно наличие шести ближайших соседей, расположенных по октаэдру; для двухвалентного Pd — четырёх, занимающих вершины квадрата (например, в структуре PdCl 2). Для объяснения подобных закономерностей обычно используются методы квантовой механики (см. Квантовая химия ) . Кристаллоструктурный аспект включает в себя исследование относительного расположения фрагментов структуры (и одноатомных ионов) в пространстве кристаллического вещества. В случае молекулярных кристаллов исследуется укладка молекул. Причины образования той или иной кристаллической структуры определяются общим принципом термодинамики: наиболее устойчива структура, которая при данном давлении и данной температуре имеет минимальную свободную энергию. Приближённые расчёты свободной энергии и предсказание наиболее выгодной структуры возможны пока лишь для сравнительно простых случаев, причём точность расчёта значительно ниже точности эксперимента.
В области исследований зависимости свойств кристаллов от их строения К. перекрывается с кристаллофизикой и физикой твёрдого тела.
Лит.: Белов Н. В., Структура ионных кристаллов и металлических фаз, [М.], 1947; Бокий Г. Б., Кристаллохимия, 3 изд., М., 1971; Китайгородский А. И., Органическая кристаллохимия, М., 1955; Киттель Ч., Введение в физику твердого тела, пер. с англ., 2 изд., М., 1962; Ормонт Б. Ф., Введение в физическую химию и кристаллохимию полупроводников, М., 1968; Кребс Г., Основы кристаллохимии неорганических соединений, пер. с нем., М., 1971.
П. М. Зоркий.
Кристаллы в клетках растений
Криста'ллыв клетках растений, кристаллические отложения в полостях или оболочках живых или отмерших клеток, состоящие главным образом из щавелевокислого Ca, кремнезёма — SiO 2, реже — белков, каротинов и др. Встречаются: одиночные К., скопления мелких К. — «песок», сростки К. — друзы, игольчатые К. — стелоиды и рафиды. Некоторые К. присутствуют лишь в особых, более крупных клетках. К. могут заполнять клетки целиком, деформируя их. Кремнезём откладывается преимущественно в оболочках клеток, часто в кожице (хвощи, злаки). К. белка встречаются в ядрах, пластидах, алейроновых зёрнах, К. каротина — в хромопластах. Много К. скапливается в отмерших клетках листьев и коры. Форма и расположение К. специфичны для ряда растений, что может иметь значение для их систематики.
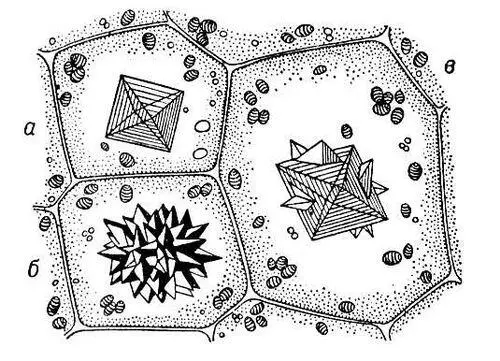
Кристаллы в клетках растений: а — простой кристалл; б и в — друзы (сростки кристаллов).
Кристаллы (физич.)
Криста'ллы(от греч. krýstallos, первоначально — лёд, в дальнейшем — горный хрусталь, кристалл), твёрдые тела, имеющие естественную форму правильных многогранников ( рис. 1 ). Эта форма — следствие упорядоченного расположения в К. атомов, образующих трёхмерно-периодическую пространственную укладку — кристаллическую решетку. К. — равновесное состояние твёрдых тел. Каждому химическому веществу, находящемуся при данных термодинамических условиях (температуре, давлении) в кристаллическом состоянии, соответствует определённая кристаллическая атомная структура. К. обладают той или иной симметрией атомной структуры, соответствующей ей макроскопической симметрией внешней формы, а также анизотропией физических свойств. К., выросший в неравновесных условиях и не имеющий правильной огранки или потерявший её в результате той или иной обработки, сохраняет основной признак кристаллического состояния — решётчатую атомную структуру и все определяемые ею свойства.
Читать дальшеИнтервал:
Закладка:
