БСЭ БСЭ - Большая Советская Энциклопедия (ЭК)
- Название:Большая Советская Энциклопедия (ЭК)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ЭК) краткое содержание
Большая Советская Энциклопедия (ЭК) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
А. Г. Воронов.
Экстракт
Экстра'кт(от лат. extractus — вытянутый, извлечённый) (мед.), вытяжка, лекарств, форма — концентрированное извлечение из лекарств, сырья, содержащее его активные начала (гликозиды, алкалоиды, витамины и др.); разновидность галеновых препаратов. В зависимости от экстрагента различают водный, спиртовой, эфирный и др. Э.; по степени сгущения после выпаривания — жидкий, густой (не более 25% влаги) и сухой (до 5% влаги) Э.
Экстрактор
Экстра'ктор,аппарат, применяемый в химической, нефтеперерабатывающей, пищевой, фармацевтической промышленности, гидрометаллургии для разделения смесей различных веществ экстракцией.
Экстракция
Экстра'кция(от позднелат. extractio — извлечение), экстрагирование, процесс разделения смеси жидких или твёрдых веществ с помощью избирательных (селективных) растворителей (экстрагентов).
Процесс Э. включает 3 последовательные стадии: смешение исходной смеси веществ с экстрагентом; механическое разделение (расслаивание) двух образующихся фаз; удаление экстрагента из обеих фаз и его регенерацию с целью повторного использования. После механического разделения получают раствор извлекаемого вещества в экстрагенте (экстракт) и остаток исходного раствора (рафинат) или твёрдого вещества. Выделение экстрагированного вещества из экстракта и одновременно регенерация экстрагента производится дистилляцией, выпариванием, кристаллизацией, высаливанием и т. п.
Достоинствами Э. являются низкие рабочие температуры, рентабельность извлечения веществ из разбавленных растворов, возможность разделения смесей, состоящих из близкокипящих компонентов, и азеотропных смесей, возможность сочетания с другими технологическими процессами (ректификацией, кристаллизацией), простота аппаратуры и доступность её автоматизации. Недостатком Э. в ряде случаев является трудность полного удаления экстрагента из экстрагируемых веществ.
Э. подчиняется законам диффузии и равновесного распределения. При Э. из жидкостей после смешения исходного раствора с экстрагентом и расслоения образовавшейся смеси концентрация у экстрагируемого вещества (В) в фазе экстракта больше его концентрации х в фазе рафината. При взаимной нерастворимости экстрагента (С) и растворителя (Л) исходного раствора зависимость у от х для равновесной системы (для которой у обозначается как у р) изображается в диаграмме у — х ( рис. 1 , а). Если раствор разбавлен, а вещество В в экстракте находится в неассоциированном и недиссоциированном состояниях, отношение 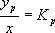 (коэффициент распределения) — величина постоянная, не зависящая от концентрации, и линия равновесия в диаграмме у — х является прямой; в противном случае K p — функция концентрации, и линия равновесия криволинейна. K pвсегда зависит от температуры, практически не зависит от давления; определяется он экспериментальным путём.
(коэффициент распределения) — величина постоянная, не зависящая от концентрации, и линия равновесия в диаграмме у — х является прямой; в противном случае K p — функция концентрации, и линия равновесия криволинейна. K pвсегда зависит от температуры, практически не зависит от давления; определяется он экспериментальным путём.
Вследствие кратковременности и несовершенства акта смешения экстрагента и исходного раствора действительная (рабочая) концентрация у всегда меньше равновесной у р . Степень приближения у к у рхарактеризует эффективность Э., а разность y p —y является его движущей силой.
В результате однократной Э. возможна сравнительно небольшая степень извлечения вещества В из исходного раствора, поэтому прибегают к многократному повторению актов смешения и последующего расслаивания взаимодействующих фаз при их встречном движении ( рис. 1 , б). Если в исходном растворе концентрация вещества В уменьшается от x 1до x 2 , то его концентрация в фазе экстракта возрастает от 0 до y 1 . Из уравнения материального баланса Э.:
Dy 1=W ( x 1- x 2 ) = М ( а )
(где D и W — соответственно расходы чистого экстрагента и чистого растворителя) можно определить расход экстрагента:
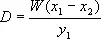
Уравнение (а) описывает прямую (см. рис. 1 , а), проходящую через точки с координатами ( x 1 , 0) и ( x 1, y 1). В приведённых выражениях x 1и y 1 — концентрации относительно чистого растворителя А и чистого экстрагента С. Очевидно, что при прочих равных условиях расход экстрагента растет по мере уменьшения концентрации ( x 2 ) вещества В в рафинате и уменьшения его концентрации y 1 в экстракте.
Кинетика Э. описывается общим уравнением массообмена. M = K  cF t , где М — количество экстрагированного вещества, К — коэффициент массопередачи,
cF t , где М — количество экстрагированного вещества, К — коэффициент массопередачи,  с — средняя разность концентраций экстрагируемого вещества в обеих фазах, F — величина межфазной поверхности, t — время.
с — средняя разность концентраций экстрагируемого вещества в обеих фазах, F — величина межфазной поверхности, t — время.
Величина  с однозначно определяется заданными концентрациями х, у и у р, поэтому для достижения больших значений М стремятся увеличить К путём турбулизации потоков взаимодействующих фаз и F — путём диспергирования одной из фаз (экстрагента или исходного раствора) на мелкие капельки. Точное значение К пока не может быть рассчитано теоретическим путём, поэтому эффективность процесса Э. выражают, как и при ректификации или абсорбции, числом ступеней равновесия (идеальных тарелок). Графическое определение числа ступеней равновесия показано на рис. 1 , а . В случае частичной растворимости растворителя А и экстрагента С равновесие системы изображается в плоскости равностороннего треугольника ( рис. 1 , в). Каждой точке внутри треугольника соответствует тройная смесь, в которой концентрации компонентов А, В, С измеряются длинами перпендикуляров, опущенных на противолежащие стороны. Под кривой EG (бинодальной кривой) расположена область гетерогенных смесей, а над кривой — гомогенных растворов. Процессы Э., поскольку в них чередуются акты смешения и расслаивания фаз, протекают только в гетерогенной области. Смешав исходный раствор с некоторым количеством экстрагента, получим тройную гетерогенную смесь Р, которая расслаивается на экстракт Q и рафинат R с концентрацией экстрагируемого вещества В. Если теперь смешать рафинат со свежей порцией экстрагента, получим новую гетерогенную смесь P 1, которая расслоится на экстракт Q 1и рафинат R 1 с более низкой концентрацией Q 1. Положение прямых QR и Q 1 R 1 , называется конодами, определяется для каждой системы экспериментальным путём. Продолжая акты смешения и расслаивания, можно добиваться дальнейшего понижения концентрации компонента В в рафинате, т. е. повышения степени Э. Совершенно очевидно, что число построенных конод (их может быть сколько угодно) равно числу ступеней равновесия. В приведённом примере периодической Э. после каждого акта смешения и расслаивания падает концентрация В как в рафинате, так и в экстракте. Для повышения концентрации вещества В в экстракте и большего его исчерпывания из рафината во многих случаях прибегают к Э. с так называемой обратной флегмой. Сущность этого процесса сводится к частичному отделению экстрагента от экстракта и исходного растворителя от рафината и обратному возвращению долей этих фракций в аппарат навстречу уходящим потокам.
с однозначно определяется заданными концентрациями х, у и у р, поэтому для достижения больших значений М стремятся увеличить К путём турбулизации потоков взаимодействующих фаз и F — путём диспергирования одной из фаз (экстрагента или исходного раствора) на мелкие капельки. Точное значение К пока не может быть рассчитано теоретическим путём, поэтому эффективность процесса Э. выражают, как и при ректификации или абсорбции, числом ступеней равновесия (идеальных тарелок). Графическое определение числа ступеней равновесия показано на рис. 1 , а . В случае частичной растворимости растворителя А и экстрагента С равновесие системы изображается в плоскости равностороннего треугольника ( рис. 1 , в). Каждой точке внутри треугольника соответствует тройная смесь, в которой концентрации компонентов А, В, С измеряются длинами перпендикуляров, опущенных на противолежащие стороны. Под кривой EG (бинодальной кривой) расположена область гетерогенных смесей, а над кривой — гомогенных растворов. Процессы Э., поскольку в них чередуются акты смешения и расслаивания фаз, протекают только в гетерогенной области. Смешав исходный раствор с некоторым количеством экстрагента, получим тройную гетерогенную смесь Р, которая расслаивается на экстракт Q и рафинат R с концентрацией экстрагируемого вещества В. Если теперь смешать рафинат со свежей порцией экстрагента, получим новую гетерогенную смесь P 1, которая расслоится на экстракт Q 1и рафинат R 1 с более низкой концентрацией Q 1. Положение прямых QR и Q 1 R 1 , называется конодами, определяется для каждой системы экспериментальным путём. Продолжая акты смешения и расслаивания, можно добиваться дальнейшего понижения концентрации компонента В в рафинате, т. е. повышения степени Э. Совершенно очевидно, что число построенных конод (их может быть сколько угодно) равно числу ступеней равновесия. В приведённом примере периодической Э. после каждого акта смешения и расслаивания падает концентрация В как в рафинате, так и в экстракте. Для повышения концентрации вещества В в экстракте и большего его исчерпывания из рафината во многих случаях прибегают к Э. с так называемой обратной флегмой. Сущность этого процесса сводится к частичному отделению экстрагента от экстракта и исходного растворителя от рафината и обратному возвращению долей этих фракций в аппарат навстречу уходящим потокам.
Интервал:
Закладка:
