БСЭ БСЭ - Большая Советская Энциклопедия (ЭТ)
- Название:Большая Советская Энциклопедия (ЭТ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ЭТ) краткое содержание
Большая Советская Энциклопедия (ЭТ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
гидрогалогенирование — к соответствующим этиленгалогенгидринам (например,

В этих и многих аналогичных реакциях Э. о. является эффективным алкилирующим агентом (с её помощью вводится b-оксиэтильная группа HOCH 2CH 2—), что широко используется в промышленности и лабораторной практике для получения ценных продуктов, например этиленциангидрина (взаимодействием с синильной кислотой ) , этиленгликоля и его моноэфиров — целлозольвов (гидратацией и алкоголизом), этаноламинов (реакцией с аммиаком), b-меркаптоэтанола HSC 2CH 2OH и (взаимодействием с сероводородом), b-фенил-этилового спирта ( Фриделя — Крафтса реакцией с бензолом). Для Э. о. характерна (также идущая с разрывом связи С—О) полимеризация. Так, при пропускании паров Э. о. при 110—160°С над NaHSO 4образуется её димер — диоксан; под каталитическим действием третичных аминов или хлорида олова (IV) Э. о. легко полимеризуется (иногда со взрывом) уже при обычной температуре. Полиэтиленоксиды [—CH 2—CH 2—O] nимеют широкий интервал молекулярных масс (от 10 2до 10 7). Различают низкомолекулярные полимеры, т. н. полиэтиленгликоли (молекулярная масса до 40 тыс.), и высокомолекулярные (от 500 тыс. до 10 млн.). Полиэтиленгликоли — жидкие или воскообразные продукты, получаемые каталитической полимеризацией Э. о. при 100 — 150°С и используемые в текстильной промышленности (как смачиватели, умягчители и антистатические агенты), в косметике и как компоненты моющих средств. Высокомолекулярные полимеры Э. о. в промышленности получают суспензионной каталитической полимеризацией при 20—50°С; они представляют собой твёрдые продукты с хорошими термопластическими и механическими свойствами, некоторой водорастворимостью; используются как флокулянты, для снижения гидродинамического сопротивления водных потоков, в текстильной промышленности (как загустители). В качестве эмульгаторов и компонентов моющих средств применяются продукты конденсации Э. о. с высшими спиртами (олеиловым, лауриловым, стеариловым), алкилфенолами, например с изооктилфенолом, с жирными карбоновыми кислотами, представляющие собой полиэтиленгликолевые эфиры типа RO (CH 2CH 2O) n—Н, где R — органический радикал, а
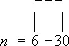 .
.
Циклические простые эфиры, получаемые из Э. о., — т. н. краунэфиры, широко применяют в органическом синтезе для разъединения ионных пар различных солей в апротонных биполярных растворителях, как, например, краун 18—6 для связывания иона калия. Основные промышленные методы получения Э. о. — каталитическое окисление этилена кислородом воздуха при 200—300°С над катализатором, содержащим металлическое серебро, и дегидрохлорирование этиленхлоргидрина. Важное значение Э. о. имеет также в тонком органическом синтезе: например реакцией её с ацетоуксусным эфиром получают ацетобутиролактон, используемый в производстве витамина B 1и являющийся промежуточным продуктом для получения противомалярийных препаратов. Э. о. токсична: в малых количествах она обладает наркотическим действием, в значительных — приводит к раздражению слизистых оболочек, удушью и отёку лёгких. Предельно допустимая концентрация Э. о. в воздухе — 0,001 мг/л.
Этиленгликоль
Этиленглико'ль,этандиол-1,2, HOCH 2CH 2OH, простейший гликоль, бесцветная вязкая жидкость со сладким вкусом; t пл— 12,3°С, t kип 196°С, плотность 1,113 г/см 3 (20°С); смешивается во всех соотношениях с водой, спиртом, ацетоном, плохо растворим в эфире, не растворим в хлороформе, алифатических и ароматических углеводородах; гигроскопичен. Важным свойством Э. является его способность сильно понижать температуру замерзания воды (до — 25°С при 40%-ном содержании Э. в воде и до —40°С при 60%-ном), что широко используется для приготовления антифризов. Подобно другим двухатомным спиртам, Э. образует моно- и дигликоляты, например HOCH 2CH 2ONa и NaOCH 2CH 2ONa, эфиры (простые и сложные) и другие производные, среди которых наибольшую практическую ценность имеют простые моноэфиры HOCH 2CH 2OR (т. н. целлозольвы ) , где R — углеводородный радикал, используемые в качестве растворителей, и сложные полиэфиры (—ОСН 2СН 2ОСО—R—CO—) n, например полиэтилентерефталат, применяемые для изготовления синтетического волокна типа лавсан (см. Полиэфирные волокна ) . Сложный эфир Э. и азотной кислоты, т. н. нитрогликоль— взрывчатое вещество. Основной промышленный метод получения Э.— гидратация этилена окиси при 10 ат и 190—200°С или при 1 ат и 50—100°С в присутствии 0,1—0,5% серной (или ортофосфорной) кислоты; в качестве побочных продуктов при этом образуются диэтиленгликоль и незначительное количество высших полимергомологов Э. В ограниченных масштабах Э. применяют также как растворитель печатных и некоторых других красок, в производстве чернил и паст для шариковых ручек, в органическом синтезе. Э. токсичен.
М. К. Грачев.
Этилендиамин
Этилендиами'н,1,2-диаминоэтан, H 2NCH 2CH 2NH 2, бесцветная жидкость с аммиачным запахом; t kип 116,5°С, t пл8,5°С, плотность 0,899 г/см 3 (20°С); растворим в воде, спирте, хуже — в эфире, нерастворим в бензоле. Сильное основание. Соли Э. с жирными кислотами используют в текстильной промышленности как смягчающие агенты; тартрат Э. обладает пьезоэлектрическими свойствами. Взаимодействием с хлоруксусной кислотой получают этилендиаминтетрауксусную кислоту. Э. применяют в производстве фунгицидов, красителей, стабилизаторов латексов, эмульгаторов, пластификаторов и др., как отвердитель эпоксидных смол. Получают главным образом действием аммиака на дихлорэтан. Э. токсичен; предельно допустимая концентрация его паров в воздухе 0,001 мг/л.
Этилендиаминтетраацетат натрия
Этилендиаминтетраацета'т на'трия,дигидрат двунатриевой соли этилендиаминтетрауксусной кислоты, трилон Б, комплексон III, бесцветные кристаллы, хорошо растворимые в воде и щелочах. Э. н. — важнейший представитель комплексонов; он образует устойчивые внутрикомплексные соединения со многими двух- и трехзарядными катионами, что используется в комплексонометрии для определения Са, Mo, Со, Cu, Ni, Zn, Fe, Mn, Al, Ga, редкоземельных элементов и косвенного определения некоторых анионов, например PO 4 3—, SO 4 2—, CN —, а также для связывания ионов, мешающих фотометрическим и титриметрическим определениям. На этом же свойстве Э. н. основано его применение для умягчения воды и удаления следов металлов в фармацевтических и химических препаратах. Получают Э. н. из этилендиамина и монохлоруксусной кислоты (см. Хлоруксусные кислоты ) .
Читать дальшеИнтервал:
Закладка:
