БСЭ БСЭ - Большая Советская Энциклопедия (ЭТ)
- Название:Большая Советская Энциклопедия (ЭТ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ЭТ) краткое содержание
Большая Советская Энциклопедия (ЭТ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Этилацетат
Этилацета'т,уксусноэтиловый эфир CH 3COOC 2H 5, бесцветная легколетучая жидкость с приятным фруктовым запахом; t kип77,1°С, t пл— 82,4 °С, плотность 0,900 г/см 3 (20°С); мало растворим в воде, хорошо — в спирте, эфире, хлороформе и др. Горит; пределы взрывоопасных концентраций в воздухе 2,2—9%. В промышленности получают этерификацией этилового спирта уксусной кислотой в присутствии H 2SO 4. Э. широко применяют как растворитель для нитратов целлюлозы в лакокрасочной промышленности (см. Нитролаки ) , при производстве фото- и кинопленки, бездымного пороха; смесь Э. со спиртом — растворитель для ацетилцеллюлозы, поливинилбутираля и некоторых других полимеров. Служит также компонентом фруктовых эссенций для прохладительных напитков, ликеров и кондитерских изделий.
Этилбензол
Этилбензо'л,C 6H 5CH 2CH 3, бесцветная жидкость; t kип136,2°С, t пл— 94,97°С, плотность 0,867 г/см 3 (20°С); почти нерастворим в воде, растворяется в спирте, бензоле, эфире, четыреххлористом углероде.
Э. содержится в нефти и каменноугольной смоле. В промышленности получают главным образом из бензола и этилена (по Фриделя — Крафтса реакции ) . При пропускании паров Э. над катализаторами образуется стирол, являющийся сырьем при производстве важных промышленных продуктов — некоторых видов пластмасс (см. Полистирол ) и каучуков синтетических. Э. используют также в органическом синтезе, например для получения ацетофенона жидкофазным каталитическим окислением, как растворитель и компонент высокооктановых бензинов. Предельно допустимая концентрация паров Э. в воздухе 0,05 мг/л.
Этилбромид
Этилброми'д,бромистый этил, бромэтан, C 2H 5Br, бесцветная жидкость со слабым эфирным запахом; t пл— 119°С, t kип38,3°С, плотность 1,459 г/см 3(20°С); плохо растворим в воде. Получают из этилового спирта: C 2H 5OH + KBr + H 2SO 4® C 2H 5Br + KHSO 4+ H 2O. Применяют в органическом синтезе для введения этильной группы C 2H 5— (см. Алкилирование ) . Входит в состав этиловой жидкости.
Этилдихлорарсин
Этилдихлорарси'н,C 2H 5AsCl 2, бесцветная маслянистая жидкость; t пл — 65°С, t kип155,3°С, плотность 1,1420 г/см 3 (14,5 °С). Э. применяли как отравляющее вещество в 1-ю мировую войну 1914—18. По токсическим свойствам аналогичен люизиту.
Этилен
Этиле'н,этен, H 2C=CH 2, ненасыщенный углеводород, первый член гомологического ряда олефинов, бесцветный газ со слабым эфирным запахом; t nл — 169,5°С, t kип— 103,8°С, плотность 0,570 г/см 3 (при t kип); практически нерастворим в воде, плохо — в спирте, лучше — в эфире, ацетоне. Температура воспламенения 540°С, горит слабокоптящим пламенем, с воздухом образует взрывоопасные смеси (3--34 объемных %). Э. весьма реакционноспособен. Наиболее характерно для него присоединение по двойной углерод-углеродной связи, например каталитическое гидрирование Э. приводит к этану:
H 2C = CH 2+ H 2® H 3C—CH 3,
хлорирование — к дихлорэтану:
H 2C = CH 2+ Cl 2® ClH 2C—CH 2Cl,
гипохлорирование (присоединение хлорноватистой кислоты) — к этиленхлоргидрину:
H 2C=CH 2+ HOCl ® HOH 2C—CH 2Cl.
Многие реакции Э. лежат в основе промышленных способов получения ряда важных продуктов; так, сернокислотной или прямой гидратацией из Э. получают этиловый спирт, каталитическим окислением — этилена окись и ацетальдегид, алкилированием бензола (по Фриделя — Крафтса реакции ) — этилбензол, полимеризацией, например в присутствии катализаторов Циглера — Натта,— полиэтилен, окислительным хлорированием — винилхлорид, сочетанием с уксусной кислотой — винилацетат, присоединением HCl— этилхлорид, взаимодействием с хлоридами серы — иприт и т. д. Основные промышленные методы получения Э.— высокотемпературный (700—850°С) пиролиз и крекинг жидких дистиллятов нефти и низших парафиновых углеводородов, главным образом этана и пропана (см. Газы нефтепереработки ) . Выделение и очистку Э. проводят ректификацией, дробной абсорбцией, глубоким охлаждением. В лабораторных условиях Э. можно получать дегидратацией этилового спирта, например нагреванием с серной или ортофосфорной кислотой.
Этилен в организме. Э. образуется в незначительных количествах в тканях растений и животных как промежуточный продукт обмена веществ. Содержащийся в различных органах высших растений (плодах, цветках, листьях, стеблях, корнях) Э. антагонистически взаимодействует с гормонами растений — ауксинами (Э. и ауксины ингибируют биосинтез и функционирование друг друга). Сдвиг в сторону преобладающего действия Э. способствует замедлению роста, ускорению старения, созревания и опадения плодов, ускорению сбрасывания цветков или только их венчиков, завязей, листьев, а в сторону преобладающего действия ауксинов — замедляет старение, созревание и опадение плодов и т. п. Пути биосинтеза Э. и его метаболизм в растительных тканях окончательно не выяснены.
Э. используют для ускорения созревания плодов (например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов), дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая. В высоких концентрациях Э. оказывает на человека и животных наркотическое действие.
Лит.: Дженсен Ю., Этилен и полиацетилены, в кн.: Биохимия растений, пер. с англ., М., 1968; Стимуляция и торможение физиологических процессов у растений, в сборнике: История и современное состояние физиологии растений, М., 1967.
Ю. В. Ракитин.
Этилена окись
Этиле'на о'кись,этиленоксид, оксиран,
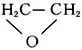 , простейший представитель эпоксидов (циклических простых эфиров с a-окисным трёхчленным кольцом), бесцветный газ с эфирным запахом; t пл — 111,3°С, t kип10,7°С, плотность 0,891 г / см 3(4°С). Э. о. хорошо растворима в воде, спирте, эфире и многих других органических растворителях; легко воспламеняется; образует с воздухом взрывоопасные смеси (3—80% по объёму). Химические свойства Э. о. определяются наличием напряжённого и вследствие этого сравнительно легко размыкающегося (под действием высокой температуры и различных химических реагентов) эпоксидного цикла. Так, при нагревании до 400°С (в присутствии Al 2O 3— при 150—300°С) Э. о. изомеризуется в ацетальдегид; гидрирование Э. о. (над никелем при 80°С) приводит к этиловому спирту
, простейший представитель эпоксидов (циклических простых эфиров с a-окисным трёхчленным кольцом), бесцветный газ с эфирным запахом; t пл — 111,3°С, t kип10,7°С, плотность 0,891 г / см 3(4°С). Э. о. хорошо растворима в воде, спирте, эфире и многих других органических растворителях; легко воспламеняется; образует с воздухом взрывоопасные смеси (3—80% по объёму). Химические свойства Э. о. определяются наличием напряжённого и вследствие этого сравнительно легко размыкающегося (под действием высокой температуры и различных химических реагентов) эпоксидного цикла. Так, при нагревании до 400°С (в присутствии Al 2O 3— при 150—300°С) Э. о. изомеризуется в ацетальдегид; гидрирование Э. о. (над никелем при 80°С) приводит к этиловому спирту
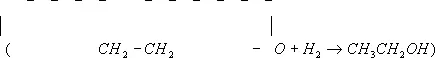
Интервал:
Закладка:
