Алина Шоричева - От водорода до мейтнерия: неорганика на ладони. Книга первая: металлы и неметаллы главных подгрупп таблицы Менделеева
- Название:От водорода до мейтнерия: неорганика на ладони. Книга первая: металлы и неметаллы главных подгрупп таблицы Менделеева
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:9785005584342
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Алина Шоричева - От водорода до мейтнерия: неорганика на ладони. Книга первая: металлы и неметаллы главных подгрупп таблицы Менделеева краткое содержание
От водорода до мейтнерия: неорганика на ладони. Книга первая: металлы и неметаллы главных подгрупп таблицы Менделеева - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Таков он, вездесущий кислород: ни горение, ни ржавление, ни дыхание не обходятся без его участия.
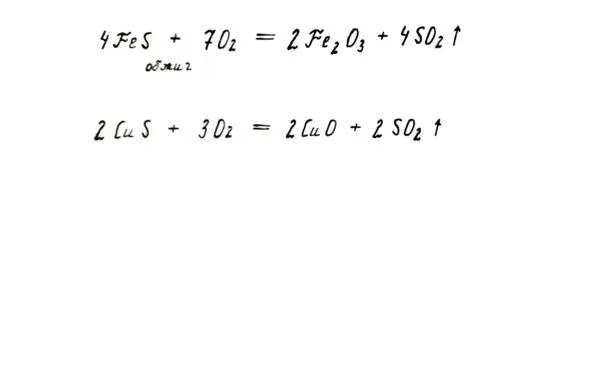
Глава 3.
Озон. Рожденный молнией
Говоря о кислороде, нельзя не упомянуть о его «брате-неблизнеце» озоне. Озон – аллотропная модификация, его молекулы состоят из трехатомов кислорода.
Озон при нормальных условиях – газ светло-голубого цвета. Постепенно охлаждаясь, он из газового состояния переходит в жидкое (темно-синяя жидкость), а затем – в твердое (черно-синие кристаллы). В минимальной концентрации запах озона ощущается как «аромат свежести», в больших количествах он приобретает резкий, неприятный характер.
Интересное строение имеет молекула озона. В ней средний атом кислорода связан ковалентными неполярными связями с двумя боковыми атомами. Но есть еще одна ковалентная связь, электронная плотность которой распределена между всеми тремя атомами кислорода. При этом атомы расположены друг относительно друга под углом порядка 117 градусов.
В атмосфере озон образуется из кислорода во время грозовых электрических разрядов, ультрафиолетового облучения в слоях стратосферы (10—15 км от Земли). Все мы, наверное, слышали об озоновом «экране», защищающем нашу среду обитания от губительного солнечного излучения. Этот «экран» хрупок и сам нуждается в защите от некоторых опасных промышленных соединений, например, атомарных хлора и брома. Эти вещества у нас на слуху под общим названием фреоны. Они применяются для работы холодильных установок и как пропелленты (наполнители) в аэрозольных баллончиках.
Озон способен быстро распадаться, выделяя атомарный кислород – сильнейший окислитель, оказывая тем самым мощное бактерицидное действие. Фактически удаляются все органические загрязнения на самых разных поверхностях, будь то одежда, инструменты, помещение в целом, вода и даже воздух. Отбеливание целлюлозы по современным методам тоже проводят с помощью озона. В общем, отдадим должное озону, важную роль он играет в жизни и деятельности человека. Но так ли отчаянно благороден этот «рыцарь в стальных доспехах»?
Запах озона ощущается рядом с работающими копировальными аппаратами и бактерицидными облучателями, то есть вблизи тех предметов, где есть электрический разряд, искра. В количествах, превышающих предельно допустимые, озон вызывает у человека сбой сердечно-сосудистой, дыхательной систем, сильную головную боль, общее плохое самочувствие. Озон может быть очень токсичным, вредным для здоровья. Поэтому так важно сотрудникам предприятий вести наблюдение за концентрацией этого газа в помещениях.
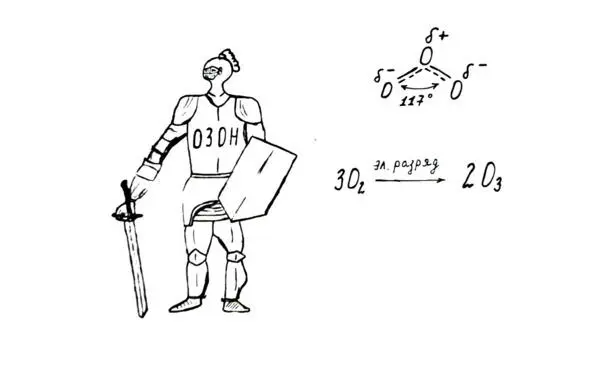
К тому же нужно учитывать «взрывоопасность» озона, многие органические вещества способны воспламеняться в его атмосфере. Но вот что интересно: не всякое органическое вещество сгорает в озоне, некоторые вещества с двойными связями в молекуле в среде разбавленного озона образуют с ним соединения-озониды. Химики-исследователи потом по составу получившегося озонида устанавливают строение исходной молекулы органического вещества.
Таков он, газ озон, рыцарь благородный и опасный. Так важно научиться правильно его применять, уважать его свойства, и тогда он будет для человека другом и помощником.
Глава 4
Перекись водорода. Антисептик с пузырьками
Как гласит народная мудрость: «Назвался груздем – полезай в кузовок!» Начал разбирать тему, так договаривай. О «брате» кислорода – озоне – мы упомянули, сам кислород тоже вниманием не обделили. А где кислород, там рядышком и соединения под названием пероксиды. Самый «знаменитый» из них – водорода пероксид (или перекись, как нам привычнее слышать).
Молекула пероксида водорода неплоская, состоит из двух атомов кислорода, соединенных друг с другом (пероксидный «мостик»), и двух атомов водорода. Связи О-Н расположены под углом относительно пероксидного «мостика».
Перекись водорода – бесцветная жидкость, несколько тяжелее воды, причем в воде растворяется неограниченно, а также в спирте и эфире. Под действием света, некоторых ферментов или катализатора (оксид марганца (IV)) пероксид водорода быстро распадается на воду и кислород.
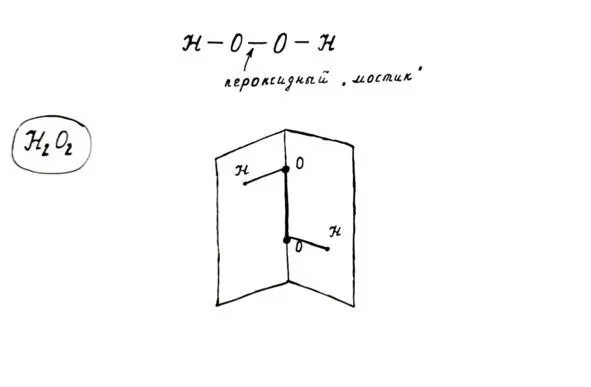
Строение молекулы пероксида водорода. Не будем забывать, что степень окисления кислорода в пероксидах равна -1
Химические свойства пероксида водорода

Распад пероксида водорода под действием катализатора
1. Как сильного окислителя. Окисляет многие восстановители: соли железа (II), йодиды, сульф иты, нитр иты.
2. Как восстановителя (с более сильными окислителями, например, с хлорной водой). Выделяется кислород.
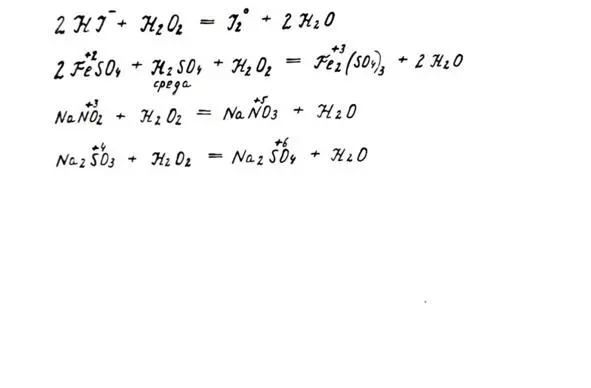
Свойства пероксида как окислителя
3. Как очень слабой кислоты (взаимодействие с некоторыми щелочами с образованием пероксидов тех металлов, которые входили в состав щелочи).
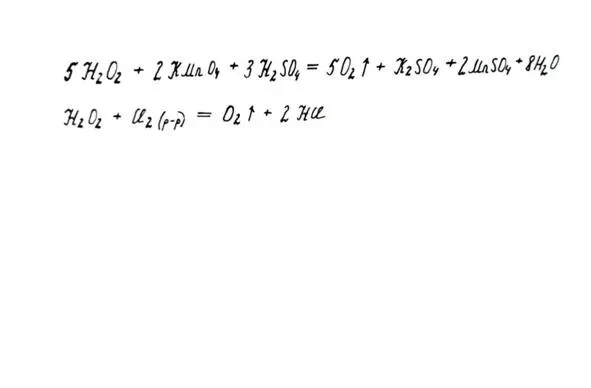
Свойства пероксида как восстановителя
Пероксид водорода находит широкое применение в медицине и промышленности. В виде трехпроцентного водного раствора известен как антисептическое средство. Все мы замечали, наверное: капнешь перекись на ранку, и ранка начинает «пузыриться», чуть ли не шипит. Это происходит распад перекиси и выделение кислорода, который рану дезинфицирует. А затевает реакцию фермент каталаза, содержащийся в крови.
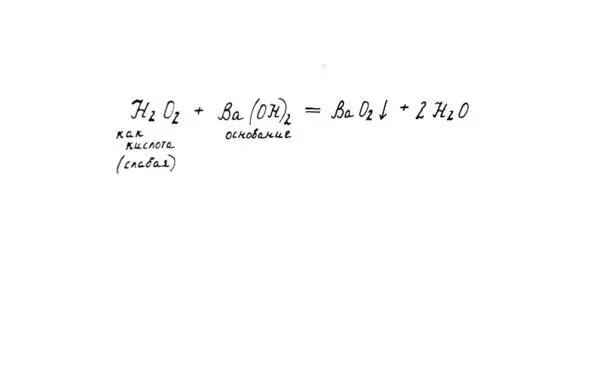
Свойства пероксида как кислоты
В промышленности используются концентрированные растворы пероксида водорода, называемые пергидролями. Они помогают отбеливать ткани, бумагу, осветлять старые слои красок на картинах, а в смеси с моющими средствами пригодны для уборки, дезинфекции. Только очень важнопри работе с пергидролем беречь кожу, чтобы не получить сильный ожог. Кроме того, пергидроль взрывоопасен.
Читать дальшеИнтервал:
Закладка:





![Петр Дружинин - Загадка «Таблицы Менделеева» [История публикации открытия Д.И.Менделеевым Периодического закона]](/books/1063991/petr-druzhinin-zagadka-tablicy-mendeleeva-istori.webp)



