Алина Шоричева - От водорода до мейтнерия: неорганика на ладони. Книга первая: металлы и неметаллы главных подгрупп таблицы Менделеева
- Название:От водорода до мейтнерия: неорганика на ладони. Книга первая: металлы и неметаллы главных подгрупп таблицы Менделеева
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:9785005584342
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Алина Шоричева - От водорода до мейтнерия: неорганика на ладони. Книга первая: металлы и неметаллы главных подгрупп таблицы Менделеева краткое содержание
От водорода до мейтнерия: неорганика на ладони. Книга первая: металлы и неметаллы главных подгрупп таблицы Менделеева - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
От водорода до мейтнерия: неорганика на ладони
Книга первая: металлы и неметаллы главных подгрупп таблицы Менделеева
Алина Шоричева
© Алина Шоричева, 2022
ISBN 978-5-0055-8434-2 (т. 1)
ISBN 978-5-0055-8435-9
Создано в интеллектуальной издательской системе Ridero
Здравствуйте, уважаемые читатели! Меня зовут Шоричева Алина. По образованию я провизор, поэтому по роду своей деятельности мне приходилось изучать такую науку, как химия. Много наук – химий, ведь они тоже бывают разными. Копился материал, рисунки, заметки, написанные от руки, а в голове роились мысли: как бы всему этому материалу «дать ума», превратить его в нечто оформленное. Но не хватало то времени, то смелости. Будем считать, что все приходит и получается тогда, когда должно. Так вот, этот книжный цикл – моя попытка взять на себя смелость и создать свое универсальное пособие, в котором бы понятно и емко рассказывалось о каждомэлементе (и его ключевых соединениях) всей таблицы Д. И. Менделеева. Я надеюсь, что мои книги станут вашими верными помощниками при подготовке к урокам, экзаменам, когда требуется что-то повторить или вспомнить, не прибегая ко множеству разных учебников.
В первой части я предлагаю начать изучение свойств металлов и неметаллов главных подгрупп периодической системы Д. И. Менделеева. Ну что же, в добрый путь, ведь, как говорил поэт В. В. Маяковский: «Если звезды зажигают, значит, это кому-нибудь нужно!»
Глава 1
Водород. Всегда на первом месте
Будем знакомы
Химический элемент Н (водород) в периодической системе химических элементов Д. И. Менделеева (здесь и далее – ПСХЭ) занимает клеточку-«квартиру» под номером 1. Правда, размещаться она имеет право сразу в двух местах: главной подгруппе I группы (IA) и главной подгруппе VII группы (VIIA).

Строение атома водорода: ядро (1 протон, 0 нейтронов) и 1 электрон.
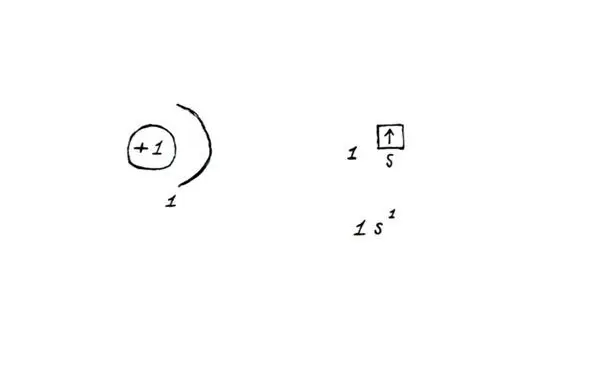
Строение атома водорода (слева) и распределение электронов на s-орбитали (справа)
Водород может «отдать» свой единственный электрон другому атому, проявляя свойства восстановителя. В этом отношении он близок к щелочным металлам (IA группа). А может присоединить 1 электрон, стать окислителем, как неметаллы VIIA группы.
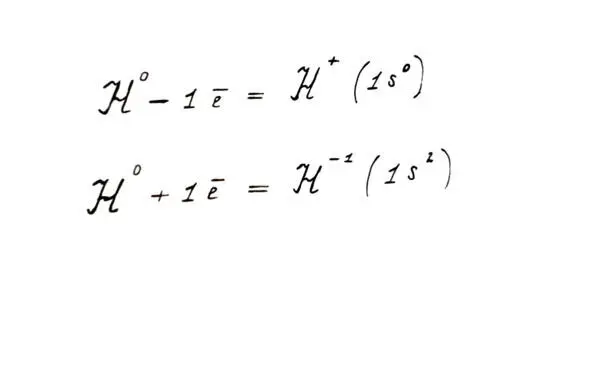
Водород как восстановитель и как окислитель
В соединениях водород имеет валентность I.
Это интересно
Помните, водород существует в виде трех изотопов:
– протий. Самый распространенный. Строение его атома: 1 протон, 0 нейтронов, 1 электрон;
– дейтерий («тяжелый» водород). Строение атома: 1 протон, 1 нейтрон, 1 электрон;
– тритий. Еще тяжелее предыдущих за счет дополнительного нейтрона. Строение атома: 1 протон, 2 нейтронаи 1 электрон. Радиоактивен.
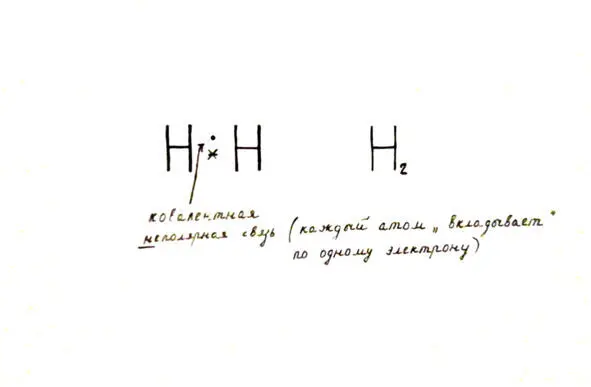
Какой я?
Молекулы простого вещества водорода состоят из двух атомов.
Это газ без цвета, вкуса и запаха. Легче воздуха. В воде нерастворим ( обратим внимание на это свойство!). Температура кипения составляет -253 градуса. Взрывоопасен!
Получение водорода
Способы получения водорода различаются в зависимости от назначения газа. Водород получают как в лабораторном кабинете (для исследований), так и на заводе для нужд промышленности.

Получение водорода в лаборатории. Газ собирают в перевернутую вверх дном пробирку путем вытеснения воздуха (водород легче воздуха) или воды (в воде водород как раз нерастворим)
Водород активно используется в химической промышленности. Он необходим для производства аммиака, хлороводорода, метанола. С помощью водорода можно получить некоторые металлы из их оксидов. Без водорода не обойтись и при производстве твердых жиров (маргарин) из жидких. А в смеси с кислородом водород возгорается, температуры такого пламени достаточно для сварки металлов.

Основные способы получения водорода в промышленности
Химические свойства водорода
1. Реакции с металлами (щелочными и щелочно-земельными). При нагревании.
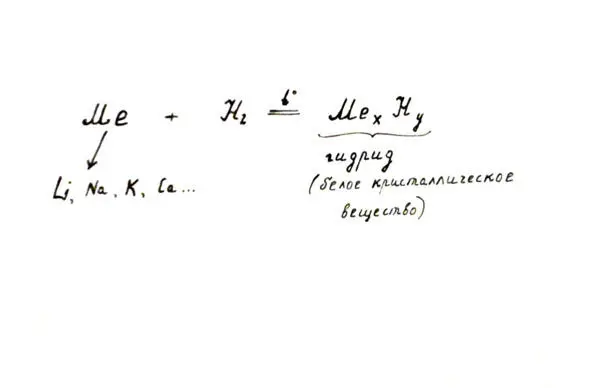
2. Реакции с неметаллами (с образованием летучих водородных соединений).

На заметку: с фосфором и кремнием непосредственно водород не реагирует! Газы фосфин и силан образуются косвенным путем
3. Реакции с оксидами металлов. Водород – в роли восстановителя. Он «забирает» себе кислород у оксида (окисляется). Так получают в промышленности некоторые металлы (медь, железо, молибден, вольфрам, цирконий).

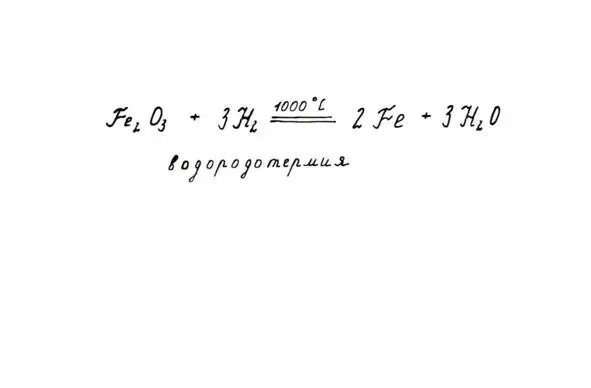
Такой способ получения металлов называют водородотермией
4. Реакция с угарным газом как промышленный способ получения метанола.
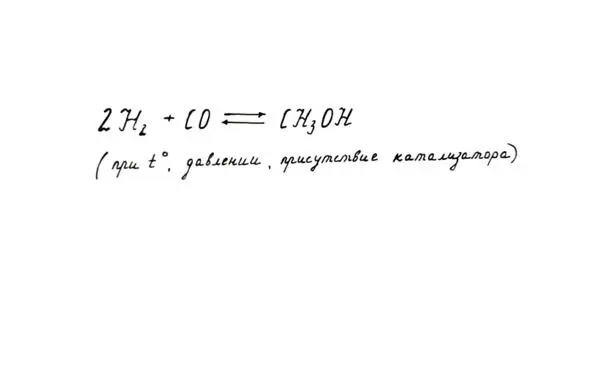
И напоследок…
1. «Чистый» водород без примеси воздуха не взрывается, а сгорает тихо, со свистом.
2. Водород благодаря малым размерам атома при определенном давлении способен растворяться в расплавах ряда металлов. Затем при охлаждении, когда металл затвердевает, часть водорода как бы «испаряется», так получают пористые металлические структуры.
Глава 2
Кислород. Горение поддерживающий
Наш следующий «химический» герой – всем известный кислород, неметалл, с которым ассоциируется не «что-нибудь», а воздух, дыхание, значит, и сама жизнь.
Читать дальшеИнтервал:
Закладка:





![Петр Дружинин - Загадка «Таблицы Менделеева» [История публикации открытия Д.И.Менделеевым Периодического закона]](/books/1063991/petr-druzhinin-zagadka-tablicy-mendeleeva-istori.webp)



