Сергей Ястребов - От атомов к древу. Введение в современную науку о жизни
- Название:От атомов к древу. Введение в современную науку о жизни
- Автор:
- Жанр:
- Издательство:Альпина нон-фикшн
- Год:2018
- Город:Москва
- ISBN:978-5-9614-5286-0
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Сергей Ястребов - От атомов к древу. Введение в современную науку о жизни краткое содержание
Рекомендуется широкому кругу читателей, всерьез интересующихся современной биологией.
От атомов к древу. Введение в современную науку о жизни - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Мир атомов довольно разнообразен. На момент написания этих строк ученым известно 118 видов атомов, которые принято называть химическими элементами. Правда, в живых телах встречаются далеко не все из них, а те, что встречается, распределены там очень неравномерно.
Хорошая новость заключается в том, что атомы часто бывают очень долговечными. В тех процессах, которые непосредственно изучает биология, они почти никогда не распадаются, не возникают заново и не превращаются друг в друга. Это не означает, что они не превращаются друг в друга вообще никогда: очень скоро мы увидим, что, если бы не было взаимных превращений атомов (точнее, их ядер), во Вселенной не смогла бы возникнуть жизнь. Однако для понимания того, как устроены живые тела, нам будет вполне достаточно учитывать взаимодействие готовых и неизменных атомов между собой.
Кратко про атомы
Итак, атомы.
Уже довольно давно известно, что они состоят из трех типов элементарных частиц: протонов, нейтронов и электронов (см. рис. 1.1А). Протоны и нейтроны — частицы относительно массивные, любой из них примерно в 1800 раз тяжелее электрона. Из протонов и нейтронов состоит атомное ядро, а из электронов — внешняя оболочка атома, которую обычно прямо так и называют электронной оболочкой. Электроны, образующие оболочку, перемещаются вокруг ядра по чрезвычайно сложным траекториям, но, как правило, не слишком от него удаляясь.
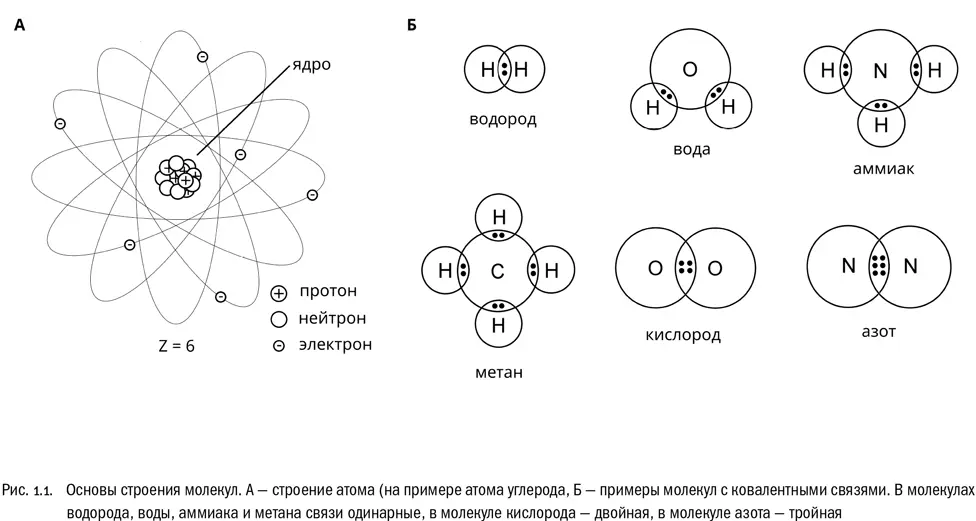
Самое важное для нас свойство элементарных частиц даже не масса, а электрический заряд. Здесь действуют абсолютно четкие и очень простые закономерности.
• Протон электрически заряжен положительно, электрон — отрицательно, а нейтрон не имеет никакого заряда.
• По величине отрицательный заряд электрона строго равен положительному заряду протона. Принято считать, что протон имеет заряд +1, а электрон −1.
• Число электронов в атоме по умолчанию равно числу протонов, так что заряд целого атома равен нулю. Если же число электронов отличается от числа протонов, значит, перед нами не просто атом, а заряженная частица — ион.
Физики еще в XVIII веке выяснили, что электрические заряды бывают двух типов: положительные и отрицательные. Также они обнаружили, что разноименные заряды притягиваются, а одноименные отталкиваются. Этот закон называется основным законом электростатики, или законом Кулона (на самом деле он записывается формулой, позволяющей точно определить силу притяжения или отталкивания, но мы тут обойдемся без математики). Закон Кулона действует где угодно, в том числе и внутри атома. Собственно говоря, электроны и протоны потому и образуют единый атом, что они электростатически притягиваются друг к другу. Для справки добавим, что протоны и нейтроны «склеиваются» в атомное ядро притяжением совсем другого рода — так называемым сильным ядерным взаимодействием, которое на маленьких расстояниях гораздо мощнее электростатического. Именно поэтому протоны в ядре держатся вместе, несмотря на отталкивающую их друг от друга кулоновскую силу.
Самый главный параметр любого атома — это число протонов, или атомный номер (Z). Величина Z однозначно определяет положение данного атома в периодической системе элементов, то есть в таблице Менделеева. Как мы уже знаем, число электронов обычно равно числу протонов. А вот что касается числа нейтронов, то оно может при одном и том же числе протонов быть разным. Атомы, имеющие одинаковый атомный номер, но разное число нейтронов, называются изотопами . Если слово «изотопы» не упоминается, значит, число нейтронов нам в данном случае неважно. Все атомы, имеющие одинаковое число протонов, по определению относятся к одному химическому элементу .
Самый простой из всех возможных атомов — водород (Z=1). Он состоит из одного протона и одного электрона. Нейтронов в нем может не быть вовсе (хотя могут и быть, в зависимости от того, какой это изотоп). Если лишить обычный простейший атом водорода его единственного электрона, от него останется положительно заряженный ион, в данном случае представляющий собой не что иное, как «голый» протон.
Еще в начале XIX века английский химик и врач Уильям Праут выдвинул опередившую свое время гипотезу, что атомы всех других химических элементов образуются в результате объединения того или иного количества атомов водорода [6] Brock W. H. The life and work of William Prout // Medical history , 1965, V. 9, № 2, 101–126.
. И он был не так уж далек от истины. Все атомы действительно состоят из однотипных частиц, самый простой возможный набор которых дает не что иное, как атом водорода (Z=1). Второй по сложности атом — гелий (Z=2), третий — литий (Z=3), ну а дальше в нашем распоряжении вся таблица Менделеева. Самые тяжелые атомы содержат больше сотни протонов и около двух сотен нейтронов. Но с такими чудовищами мы в биологии не встретимся.
Химические связи
Самый важный для нас способ взаимодействия атомов называется ковалентной связью (см. рис. 1.1Б). Это связь, образуемая общей парой электронов — по одному от каждого из двух атомов. Можно считать, что электроны этой пары принадлежат обоим атомам сразу. На графических формулах, отображающих строение молекул наглядно, ковалентную связь обозначают простой чертой между символами химических элементов. Именно такими связями и соединены атомы в большинстве обычных молекул. Пример — молекула водорода. Она состоит из двух атомов водорода (H), образующих единственную ковалентную связь между собой: H−H, или сокращенно H 2.
Иногда ковалентные связи бывают двойными — образованными сразу двумя парами электронов — или даже тройными — образованными сразу тремя парами. Чем выше кратность связи, тем эта связь при прочих равных условиях прочнее. Двойные ковалентные связи встречаются в биологии очень часто. Тройные — намного реже, но знать об их существовании все-таки не помешает. На графических формулах двойные и тройные связи обозначают, соответственно, двойными или тройными черточками между символами атомов. Например, между атомами кислорода (O) вполне может образоваться двойная связь. В результате получится молекула O=O, или сокращенно O 2. Кстати, это и есть тот самый атмосферный кислород, которым мы дышим.
Гораздо реже ковалентной (по крайней мере, в живой материи) встречается ионная связь , представляющая собой электростатическое притяжение заряженных частиц. Мы уже знаем, что по закону Кулона одноименные электрические заряды отталкиваются, а разноименные — притягиваются. Поэтому положительно заряженная частица (катион) и отрицательно заряженная (анион) обязательно притянутся друг к другу. Уже упоминалось, что ионом называется любая самостоятельно существующая частица, в которой число электронов отличается от числа протонов. Сам этот термин, предложенный Майклом Фарадеем, происходит от греческого слова, означающего «идущий»: в растворе, через который пропущен электрический ток, положительно заряженные ионы движутся к отрицательному полюсу, а отрицательные — к положительному Атом становится ионом, если он приобрел лишний электрон или, наоборот, часть своих электронов где-то потерял.
Читать дальшеИнтервал:
Закладка:









