Сергей Ястребов - От атомов к древу. Введение в современную науку о жизни
- Название:От атомов к древу. Введение в современную науку о жизни
- Автор:
- Жанр:
- Издательство:Альпина нон-фикшн
- Год:2018
- Город:Москва
- ISBN:978-5-9614-5286-0
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Сергей Ястребов - От атомов к древу. Введение в современную науку о жизни краткое содержание
Рекомендуется широкому кругу читателей, всерьез интересующихся современной биологией.
От атомов к древу. Введение в современную науку о жизни - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Отличный пример ионной связи демонстрирует всем известная поваренная соль NaCl (натрий хлор), формулу которой можно переписать как [Na +][Cl −]. Это означает, что кристалл соли состоит из положительно заряженных ионов натрия и отрицательно заряженных ионов хлора в соотношении один к одному. В данном случае каждый атом хлора как бы отбирает один электрон у соседнего атома натрия.
Элементы жизни
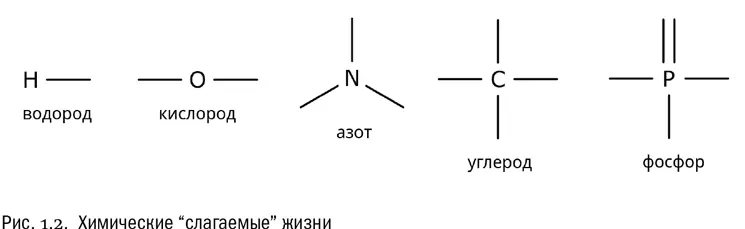
Химический состав живой материи довольно однообразен. Для того чтобы в первом приближении разобраться в устройстве живой клетки, достаточно знать всего-навсего пять химических элементов. Это водород (H), кислород (O), азот (N), углерод (C) и фосфор (P). На атомные номера этих элементов мы пока не будем обращать внимания: во-первых, нет ничего легче, чем найти их в таблице Менделеева, а во-вторых, для нас сейчас гораздо важнее другой показатель. Самое главное, что нам нужно знать о любом химическом элементе, — это его валентность , то есть число ковалентных связей, которые может образовать его атом.
Итак, валентность водорода равна 1, кислорода — 2, азота — 3, углерода — 4 и фосфора — 5. Эти числа надо просто запомнить. Иногда у некоторых из перечисленных элементов бывают и другие валентности, но, занимаясь биологией, это можно игнорировать во всех случаях, кроме немногих особо оговоренных. Одновалентный водород, двухвалентный кислород, трехвалентный азот, четырехвалентный углерод и пятивалентный фосфор — главные химические слагаемые жизни (см. рис. 1.2).
Иногда по ходу разговора нам будут встречаться и другие атомы, например сера (S), натрий (Na), хлор (Cl), калий (K) или железо (Fe). Но постоянно помнить о них не надо. Пяти главных биогенных (то есть образующих жизнь) химических элементов для начала вполне достаточно.
Сверхновые и жизнь
Не подлежит сомнению, что большинство атомов в нашей Вселенной — это атомы водорода и гелия. Астрофизики утверждают, что 13 миллиардов лет назад, то есть «всего лишь» через несколько сот миллионов лет после Большого взрыва, соотношения были следующими: примерно 75 % всех атомов во Вселенной составляли атомы водорода, примерно 25 % — атомы гелия, а на атомы всех более тяжелых элементов, вместе взятых, приходилось 0,00007 % [7] Caffau E. et al. An extremely primitive halo star // arXiv preprint arXiv: 1203.2612 (2012).
. Конечно, с тех пор Вселенная изменилась. Но и сейчас все элементы, кроме водорода и гелия, составляют в сумме не больше 2 % существующих атомов. Между тем очевидно, что из водорода, валентность которого равна единице, и гелия, который вообще неохотно образует химические связи, никаких сложных молекул не построишь.
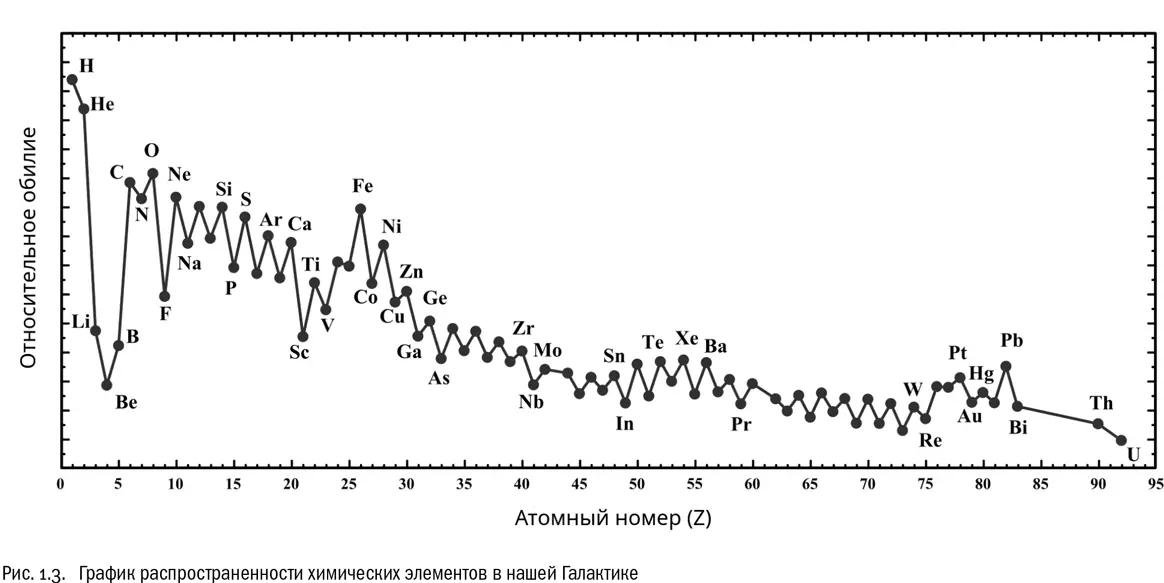
Сравнив количество разных видов атомов в современной Вселенной, мы сразу увидим, что самые распространенные в ней после водорода и гелия элементы — кислород (Z=8), углерод (Z=6) и азот (Z=7). Это можно наглядно показать на графике, изображающем относительное обилие химических элементов в нашей галактике Млечный Путь (см. рис. 1.3). По горизонтальной оси там можно отложить атомный номер (Z), а по вертикальной — распространенность элементов, причем желательно в логарифмическом масштабе (попросту говоря, это означает, что каждая «ступенька» на вертикальной оси соответствует разнице не на единицу, а в 10 раз). На таком графике первым делом бросается в глаза уже известный нам факт: водорода и гелия в Галактике во много раз больше, чем всех остальных химических элементов вместе взятых. Эти два элемента — вне конкуренции. В области лития (Z=3), бериллия (Z=4) и бора (Z=5) наблюдается явный провал, потому что ядра этих атомов относительно неустойчивы: в системе ядерных реакций, происходящих в звездах, они легко синтезируются, но так же легко и распадаются. Ядро железа (Z=26), наоборот, исключительно устойчиво. Многие ядерные реакции, идущие в недрах звезд, на нем заканчиваются, поэтому железо дает на графике высокий пик. Но самые распространенные после водорода и гелия элементы в Млечном Пути, несомненно, кислород, углерод и азот, именно те, которые стали химическими «кирпичиками» жизни. Вряд ли это случайность.
Кроме того, нельзя не заметить, что график обилия химических элементов в Галактике — отчетливо «зубчатый». Элементы с четными атомными номерами в среднем встречаются во Вселенной намного чаще, чем элементы «примерно того же достоинства» с нечетными. Еще сто лет назад на это независимо друг от друга обратили внимание два химика — итальянец Джузеппе Оддо и американец Уильям Харкинс. Их статьи вышли, соответственно, в 1914 и 1917 годах [8] Oddo G. Die molekularstruktur der Radioaktiven atome // Zeitschrift fur anorganische und allgemeine Chemie , 1914, V. 87, № 1, 253–268. Harkins W. D. The evolution of the elements and the stability of complex atoms. I. A new periodic system which shows a relation between the abundance of the elements and the structure of the nuclei of atoms // Journal of the American Chemical Society , 1917, V. 39, № 5, 856–879.
. А правило, согласно которому элементы с четными номерами при прочих равных условиях преобладают над элементами с нечетными номерами, до сих пор называется в их честь правилом Оддо — Харкинса. Это правило обязательно приходится принимать во внимание, например при анализе химического состава земной коры [9] Binnemans K. et al. Rare-earth economics: the balance problem // JOM , 2013, V. 65, № 7, 846–848.
.
Разгадка правила Оддо — Харкинса была предложена уже его первооткрывателями. Дело в том, что атомные ядра тяжелых элементов образуются в основном за счет слияния более легких ядер. Между тем ясно, что при слиянии двух одинаковых атомных ядер в любом случае получится ядро элемента с четным числом протонов, то есть с четным атомным номером. А затем образовавшиеся ядра сливаются друг с другом, давая опять же в первую очередь элементы с четными номерами. Например, «горение» гелия (Z=2), при котором его ядра объединяются друг с другом с большим выходом энергии, дает сначала неустойчивые короткоживущие ядра бериллия (Z=4), потом ядра углерода (Z=6), а потом и кислорода (Z=8).
До начала звездообразования во Вселенной были только водород, гелий и следовые количества лития. Насколько мы сейчас знаем, все элементы тяжелее лития синтезируются только в звездах и распространяются в результате взрывов сверхновых [10] Burbidge E. M. et al. Synthesis of the elements in stars // Reviews of Modern Physics , 1957, V. 29, № 4, 547–650.
. Это означает, что живым организмам было просто не из чего образоваться, пока не закончился жизненный цикл хотя бы первого поколения звезд и эти звезды не взорвались.
Авторами самой знаменитой статьи, описавшей механизм синтеза химических элементов в звездах, были четверо ученых: Маргарет Бербидж, Джеффри Бербидж, Уильям Фаулер и Фред Хойл. Эту статью часто называют по инициалам авторов «B 2FH» («бэ-квадрат-эф-аш»). Инициатором исследования был астрофизик Хойл: именно он первым догадался, что в звездах может синтезироваться не только гелий, но и углерод. Благодаря Хойлу в работу включились сперва профессиональный физик-ядерщик Фаулер (поначалу он был настроен скептически, но Хойл его переубедил), а потом астрономы Бербиджи. В сети легко найти замечательную фотографию, на которой все четверо отмечают 60-й день рождения старшего из них — Фаулера, а последний радуется действующей модели паровоза, которую ему подарили коллеги.
Читать дальшеИнтервал:
Закладка:









