В. Донцов - Доклады МОИП. Секция Геронтологии. Том 67
- Название:Доклады МОИП. Секция Геронтологии. Том 67
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:9785005143037
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
В. Донцов - Доклады МОИП. Секция Геронтологии. Том 67 краткое содержание
Доклады МОИП. Секция Геронтологии. Том 67 - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
В-третьих , при сопоставлении продолжительности жизни клеток в кровяном русле c активностью СОД [57, 58], уровнем генерации супер-оксидных радикалов в гранулоцитах [75], тромбоцитах [94], эритроцитах [95] и лимфоцитах [90] видно, что гранулоциты обладают наименьшей активностью СОД, экзогенно генерируют супер-оксидный радикал и живут только 12—14 часов. А лимфоциты при высокой активности СОД экзогенно не генерируют супер-оксидные радикалы и живут 400 и более дней. Т.е. продолжительности жизни клеток крови во многом определяется степенью окислительного «стресса».
Влияние антиоксидантов-геропротекторов на репликативное старение диплоидных клеток человека [56].
Монослойное культивирование сопровождается закономерным изменением числа делящихся клеток в течение каждого пересева: в логарифмической фазе роста культуры, с 1-го по 3-ий день роста, – максимальное число делящихся клеток.
Монослой клеток образуется к 3-4-му дню культивирования. К 9-му дню культуры переходят в стационарную фазу, когда число делящихся клеток незначительно и плотный пласт фибробласто-подобных параллельно-ориентированных клеток.
В некоторых культурах в эти сроки клетки располагаются в несколько слоев – один слой перпендикулярно к другому. Вероятно, различные фазы роста после пересева моделируют состояние клеток в различных популяциях организма: возобновляющихся, растущих или стабильных популяциях.
Добавляя антиоксиданты на различных фазах роста культуры, мы воздействовали на клетки в состоянии деления и покоя. Культура в логарифмической фазе роста подобна быстро обновляющимся клеточным популяциям, а культура в стационарной фазе – медленно обновляющимся популяциям клеток взрослого организма.
При воздействии антиоксидантов на культуры лаг-фазы и фазы логарифмического роста, т.е. при добавлении эмоксипина в момент пересева число меченых 3Н-тимидином клеток достоверно увеличивается. Для изучения влияния эмоксипина на пролиферацию клеток только в экспоненциальной фазе роста культуры препарат вводили в среду через 24 часа после пересева и фиксировали еще через 24 часа, т.е. через 48 часов после пересева. В этом случае препарат даже в высокой концентрации не влиял на пролиферацию. Число меченых клеток составило в контрольных культурах Si±σ = 92,7±1,4% (11 пассаж).
В отличие от этого, введение эмоксипина в культуры, находящиеся в стационарной фазе, существенно стимулировало пролиферацию клеток. Культура стационарной фазы характеризовалась почти полным прекращением пролиферации клеток [77].
Добавление эмоксипина приводило к существенному увеличению числа меченых клеток (таблица 4).
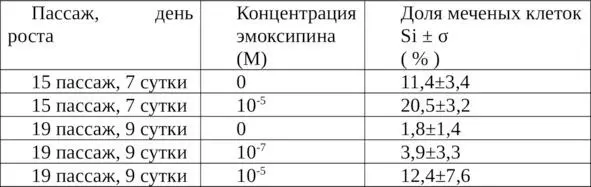
Таблица 4. Изменение индекса меченых 3Н-тимидином клеток в стационарной культуре диплоидных клеток легкого эмбриона человека через 24 часа после добавления эмоксипина и 3Н-тимидина.
Относительно контрольных культур, которые характеризуются малой величиной числа меченых клеток (в соответствии с глубиной выраженности стационарной фазы – 11,4±3,4% и 1,8±1,4%), это увеличение выглядит более значительным (до 20,5±3,2 и 12,4±7,6% соответственно), чем в пролиферирующих культурах. Таким образом, относительная величина стимуляции возрастает с уменьшением числа ДНК-синтезирующих клеток в контрольной культуре. Под влиянием антиоксиданта число меченых клеток в стационарной фазе увеличивается примерно на 10%.
Известно, что в процессе пассирования культур диплоидных клеток человека происходит характерное для старения нормальных клеток снижение числа меченых 3Н-тимидином клеток [82, 86]. Так, в наших исследованиях на 13-м и 45-м пассажах через 48 часов культивирования число меченых клеток было 80,8±5,5% и 29,0±2,2%.
Мы изучали также влияние эмоксипина на пролиферацию ДКЧ при постоянном присутствии препарата (10 —5 М эмоксипина, на протяжениии 25 суток)
на протяжении семи пассажей (с 36-го до 42-й пассаж). В этих условиях эмоксипин замедлял снижение числа клеток, синтезирующих ДНК, по мере культивирования, то есть тормозил характерное для пролиферативного старения диплоидных клеток человека снижение пролиферации. Так, в контрольных культурах с 36-го по 42-ой пассаж доля клеток, синтезирующих ДНК, снизилась с 88,7±3,7% до 66,0±8,0%. Тогда как в присутствии 10 —5 М эмоксипина доля клеток, синтезирующих ДНК, на 42-ом пассаже составила только 83,6±1,7%.
Следует подчеркнуть, что в данном эксперименте при постоянном присутствии антиоксиданта в течение 7 пассажей не наблюдали изменений кариотипа и морфологии клеток. Что позволило сделать важный вывод об отсутствии токсического действия эмоксипина в дозах 10 —5М на нормальные клетки человека.
Эти данные хорошо согласуются с фактами стимуляции антиоксидантами митотической активности клеток паренхимы печени и клеток эпителия тонкой кишки мышей in vivo [37, 59, 60]. Добавление в пищу мышам эмоксипина стимулировало кроветворение после кровопотери у мышей старших возрастных групп [69, 70]. Показано, что при введении антиоксидантов в дозах, увеличивающих антиокислительную активность (АОА), происходит ускорение деления клеток и уменьшения среднего времени генерации.
Напротив, антиоксиданты в дозах, уменьшающих антиокислительную активность, тормозят размножение клеток, тормозя их вступление в митоз [3, 4]
Для объяснения этих экспериментальных данных было выдвинуто несколько гипотез [5, 83, 97, 98]. Гипотезу Е. Б. Бурлаковой [5, 6, 79] можно проиллюстрировать схемой, составленной по её работам и представленной на рисунке 5.
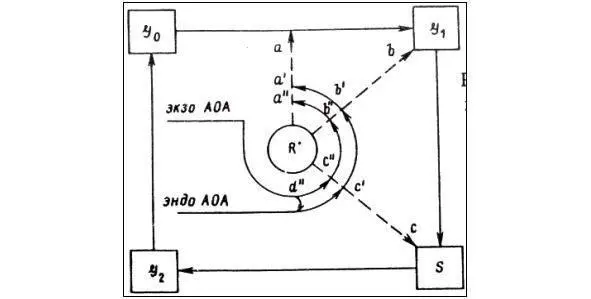
Рис. 5. Схема влияния экзогенных, эндогенных антиоксидантов и антиокислительной активности липидов на фазы клеточного цикла
(G 0, G 1, S, G 2). экзо АОА – экзогенные антиоксиданты, эндо АОА – эндогенные антиоксиданты, R• – свободные радикалы.
Действие свободных радикалов (R•) в наиболее чувствительные фазы клеточного цикла может подавить или полностью блокировать деление клеток (a, b, c). Эндогенные антиоксиданты, характеризующиеся высокой антиокислительной активностью, ингибируют свободно-радикальные процессы и снимают этот блок (a’, b’, c’). Той же способностью обладают и экзогенные антиоксиданты (a», b», c»). Кроме того введение экзогенных антиоксидантов способствует увеличению окисляемости эндогенных липидов и уменьшению эндогенной антиокислительной активности (d»). Таким образом, биологическая система поддерживает оптимальный уровень антиокислительной активности. Материальным субстратом, в котором осуществляется этот процесс, являются липидные образования (мембраны и липопротеиды).
Читать дальшеИнтервал:
Закладка:

![Марк Бернелл - Ритм-секция [litres]](/books/1072548/mark-bernell-ritm-sekciya-litres.webp)








