Британская ассоциация по ветеринарии мелких животных - Руководство по репродукции и неонатологии собак и кошек
- Название:Руководство по репродукции и неонатологии собак и кошек
- Автор:
- Жанр:
- Издательство:Софион
- Год:2005
- Город:Москва
- ISBN:5-9668-0008-1
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Британская ассоциация по ветеринарии мелких животных - Руководство по репродукции и неонатологии собак и кошек краткое содержание
Эта книга, созданная международным коллективом авторов, — авторитетных специалистов по репродукции животных — отражает современные подходы, используемые при разведении собак и кошек, все основные методы как диагностики и лечения репродуктивных нарушений, так и контроля репродукции этих животных.
Рассматриваются следующие вопросы: нормальная физиология собак и кошек; болезни репродуктивной системы; бесплодие самок и бесплодие самцов; нормальное функционирование и дисфункция молочных желез; спаривание; искусственное осеменение; протекание беременности и роды; уход за новорожденными щенками и котятами, их наследственные и инфекционные болезни; техника оперативных вмешательств на репродуктивных органах; фармакологический контроль репродукции.
Книга названа руководством — руководством она и является в силу полноты охвата материала, систематичности изложения и выраженной практической направленности.
Предназначена для ветеринарных врачей, студентов и преподавателей ветеринарных факультетов и академий.
Руководство по репродукции и неонатологии собак и кошек - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Проблема:Врожденный дефект — сниженное либидо.
Действия:Исключить животное из племенного разведения, поскольку такие дефекты часто являются наследственными.
СБОР И АНАЛИЗ СПЕРМЫ
Сперму собирают с помощью искусственной вагины или электроэякуляции. Кроме двух названных методов практикуется лаваж влагалища после вязки или извлечение сперматозоидов из хвоста придатка после кастрации.
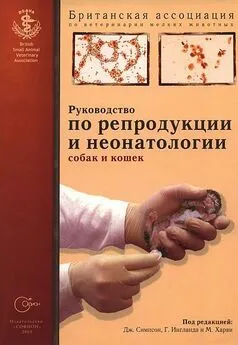
Искусственную вагину изготавливают из резинового «пальца» от пипетки Пастера и небольшой пробирки (фиг. 10.3). Самцу позволяют сделать садку на течную самку и подносят искусственную вагину, направив в нее пенис самца (фиг. 10.4). К недостаткам данного метода можно отнести необходимость присутствия возбужденной самки, а также невозможность проведения манипуляции без предварительной подготовки самца, занимающей 2–3 недели. Процедура завершается успехом лишь в 2/3 случаев. Сбор спермы с помощью искусственной вагины эффективен при работе с лабораторными животными, но редко практикуется в клинических условиях.

Искусственная вагина для сбора спермы состоит из резинового «пальца» и пробирки
Получение спермы с помощью искусственной вагины
Манипуляция не требует предварительной подготовки кота, однако проводится под общей анестезией для того, чтобы животное не испытывало неприятных ощущений. В прямую кишку вводят ректальный зонд (1 x 12 см), изготовленный из нетоксичного пластика и соединенный с электрическим стимулятором (фиг. 10.5). Зонд снабжен тремя электродами (1,5 мм х 5 см), два из которых (наружные) соединяют между собой, а центральный имеет противоположную полярность. Для предотвращения попадания слизистой прямой кишки между зондом и электродами последние должны плотно прилегать к корпусу зонда. Лаборатория автора использует электроэякулятор, работающий на частоте 50 Гц, снабженный трансформатором, обеспечивающим продолжительные импульсы мощностью от 0 до 30 вольт. Прибор работает от источника напряжения 220 вольт. Сила тока и напряжение регулируются с помощью вольтметра и амперметра.

Оборудование для электроэякуляции у котов. Электрический стимулятор и ректальный зонд с тремя электродами
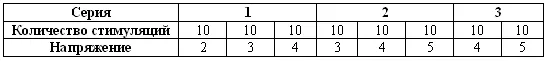
После проведения анестезии зонд смазывают и осторожно вводят в прямую кишку на 7–9 см, направляя электроды вентрально. Пенис обнажают легким нажатием на его основание и подносят к нему лабораторную пробирку. Серия из 80 импульсов мощностью от 2 до 5 вольт обеспечивает эякуляцию (табл. 10.2). Общая последовательность манипуляций включает три серии: 30 стимуляций (по 10 при 2, 3 и 4 вольтах), 30 стимуляций (по 10 при 3, 4 и 5 вольтах) и 20 стимуляций (по 10 при 4 и 5 вольтах). Между сериями делают паузы продолжительностью 2–3 минуты. Стимуляцию начинают, повышая напряжение в течение 1 секунды с 0 вольт до требуемого, после чего выдерживают 2–3 секунды при этом напряжении и резко снижают его до 0, снова выдерживая 2–3 секунды. Существуют иные методики, предусматривающие другие напряжения и длительность стимуляций. Каждый разряд сопровождается реакцией, выражающейся в вытягивании задних конечностей, что указывает на адекватность раздражения. Отсутствие реакции при напряжении 2 вольт и более свидетельствует о неправильном положении электродов или о наличии в прямой кишке каловых масс. В ходе эякуляции часть сперматозоидов попадает в мочевой пузырь, эта особенность эякуляторного процесса является нормой для домашних кошек, но может усиливаться в результате применения альфа-2 стимуляторов адренорецепторов (ксилазин и медетомидин) для седации.
Метод не распространен в клинической практике, поскольку лишь немногие коты способны к вязке в незнакомом месте, тем более в клинике. Другой недостаток метода заключается в необходимости назначения кошке седативных препаратов, а также в том, что секрет влагалища и жидкость, используемая для процедуры (солевой раствор, подогретый до 37 °C), могут влиять на качество спермы. Метод практикуют при невозможности получить сперму с применением искусственной вагины или электроэякуляции.
После кастрации сперму получают из хвоста придатка путем вымывания сперматозоидов из протока придатка или измельчения хвоста придатка. Метод применяют при сборе спермы для научных исследований или при необходимости сохранить сперму редкого вида диких животных, погибших в неволе или в результате несчастного случая.
Все материалы, соприкасающиеся со спермой, должны быть подогреты до 37 ºС для предотвращения холодового шока
Белый: высокая концентрация.
Прозрачный: низкая концентрация.
Желтый: контаминация мочой, оказывающей разрушительное воздействие на сперму, часто наблюдается при повышении напряжения свыше 8 вольт при электроэякуляции.
Измеряется с помощью микропробирки. Перед дальнейшим применением небольшой объем может быть увеличен добавлением буферного или изотонического раствора. Оценку морфологии сперматозоидов проводят перед смешиванием с раствором, поскольку разница в осмотическом давлении может увеличить количество дефектных сперматозоидов.
Подвижность сперматозоидов оценивают по шкале от 0 до 5. Нулевой подвижностью считают ее отсутствие, за 5 принимают активное поступательное продвижение.
Измеряют с помощью специальной камеры (камера Бюркера) под микроскопом. Общее количество сперматозоидов подсчитывают с учетом объема и концентрации на единицу объема
Окрашенный образец (карбол-фуксин или нигрозин-эозин) исследуют под микроскопом с 1000-кратным увеличением. Дефектными считают: головку в форме «жемчужины»; головку, имеющую суженное основание, нарушения контура, недоразвитую, отделенную или узкую головку; а также головку, имеющую отклонения в размерах.
Читать дальшеИнтервал:
Закладка: