Несса Кэри - Мусорная ДНК. Путешествие в темную материю генома
- Название:Мусорная ДНК. Путешествие в темную материю генома
- Автор:
- Жанр:
- Издательство:Лаборатория знаний
- Год:2016
- Город:Москва
- ISBN:978-5-906828-62-0
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Несса Кэри - Мусорная ДНК. Путешествие в темную материю генома краткое содержание
Расшифровав генетический код, ученые обнаружили, что лишь 2% ДНК несут информацию о белках. А для чего же тогда нужны оставшиеся 98%? Поначалу генетики решили, что это мусор, хлам. Однако совсем недавно стало ясно — все гораздо сложнее, и именно эти «мусорные» области ДНК определяют сложность человеческого организма, его возможные болезни и даже — скорость старения! Здесь — ключи к пониманию эволюции и сущности самой жизни.
Сегодня множество ученых в самых разных лабораториях мира пытаются проникнуть в тайны «мусорной» ДНК, этой темной материи нашего генома. Об их последних результатах — в увлекательной книге английского генетика Нессы Кэри.
Мусорная ДНК. Путешествие в темную материю генома - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Дальнейшие подтверждения этой гипотезы удалось получить, анализируя временной характер включения/выключения длинных некодирующих РНК и информационных РНК, которые ими регулируются (как считали ученые). Исследователи подвергали клетки воздействию стимула, который, как они уже знали, вызывает экспрессию определенного гена. Как выяснилось, усиливающая («энхансерная») длинная некодирующая РНК включалась раньше, чем информационная РНК близлежащего гена, кодирующего белок 9, 10. Это отвечает модели, согласно которой длинная некодирующая РНК, расположенная в области-энхансере, включается в ответ на стимул, а затем, в свою очередь, помогает усилить экспрессию гена, кодирующего белок (или включить этот ген).
Длинная некодирующая РНК способствует такому усилению не сама по себе. Для успешного осуществления процесса необходимо присутствие большого комплекса белков. Такой комплекс называется медиатором. Длинная некодирующая РНК связывается с медиатором, направляя его деятельность на близлежащий ген. Один из белков медиатора способен пристраивать эпигенетические модификации к соседствующему с ним гену, кодирующему белок [36] Если хотите знать, речь идет о пристраивании фосфатной группы (одного атома фосфора и четырех атомов кислорода) к определенной позиции гистона НЗ. Такую модификацию обычно связывают с активными генами.
. Это помогает рекрутировать фермент, создающий копии информационной РНК. Затем эти копии используются как матрицы для производства белка.
Существует неизменная взаимосвязь между медиатором и длинной некодирующей РНК. Искусственно вызванные понижения уровня экспрессии длинной некодирующей РНК или какого-то белка, входящего в состав медиатора, всякий раз приводили к понижению уровня экспрессии ближайшего гена 11.
Важность физического взаимодействия между длинными некодирующими РНК и медиатором показали на примере одного из генетических заболеваний человека. Речь идет о синдроме Опица-Каведжиа. Дети, родившиеся с этим недугом, испытывают трудности при обучении, у них пониженный мышечный тонус и непропорционально большая голова 12. Они наследуют мутацию одного-единственного гена. Этот ген кодирует белок медиатора, взаимодействующего с молекулами длинной некодирующей РНК [37] Данный компонент медиатора называется MED12.
.
Чем больше ученые анализировали деятельность медиатора, тем интереснее им становились эти исследования. Одной из причин такого интереса явилось то, что медиатор отвечает за действия группы энхансеров, обладающих необычными способностями. Это так называемые суперэнхансеры. Они играют особенно важную роль в эмбриональных стволовых клетках (ЭС-клетках), плюрипотентных клетках человеческого организма, которые способны стать клетками практически любого типа 13.
Суперэнхансеры — кластеры энхансеров, действующих сообща. По размерам эти кластеры примерно вдесятеро больше обычных энхансеров, а потому могут связываться с огромным количеством белковых молекул. В этом они значительно превосходят обыкновенные энхансеры. Суперэнхансеры способны резко усиливать экспрессию регулируемых ими генов. Но дело не только в числе белков, с которыми они связываются. Ученых больше интересует, что это за белки.
Как мы уже видели (глава 8), ЭС-клетки не остаются плюрипотентными по каким-то случайным причинам или просто в силу своей пассивности. Чтобы ЭС-клетки сохраняли свой потенциал, они должны очень тщательно регулировать собственные гены. Даже сравнительно малые возмущения в генетической экспрессии могут толкнуть ЭС-клетку по пути, который превратит ее в клетку специализированную. Представьте себе известную игрушку — гибкую шагающую пружину «слинки». Установим ее на верхней ступеньке длинного лестничного пролета. Малейшего толчка в нужную сторону достаточно, чтобы «слинки» начала свое весьма долгое путешествие. Может быть, лучше представить себе «слинки», которую удерживает от спуска по ступенькам небольшой грузик, прикрепленный к ее верхнему концу. Уберите груз — и пружина зашагает вниз.
Существует целый набор белков, абсолютно необходимых для поддержания плюрипотентности ЭС-клеток. Эти белки называются главными регуляторами (master regulators). Их можно уподобить грузику на верхнем конце «слинки». Уровень экспрессии главных регуляторов в ЭС-клетках очень высок, однако в специализированных клетках он гораздо, гораздо ниже.
Важную роль этих белков недвусмысленно продемонстрировали в 2006 году. Японские ученые искусственно экспрессировали комбинацию из четырех таких главных регуляторов в клетках, уже прошедших дифференциацию, обеспечив при этом очень высокие уровни экспрессии. Как ни поразительно, это породило целую череду молекулярных событий, кульминацией которых стало создание клеток, по своему действию почти идентичных ЭС-клеткам 14. Это как если бы «слинки» вдруг прошагала с нижней ступеньки обратно на верхнюю. Клетки, созданные таким способом [38] Это так называемые индуцированные плюрипотентные стволовые клетки (ИПСК).
, в организме могут превращаться в человеческие клетки практически любого типа. Замечательная работа. Изыскания, которые за ней последовали, вызвали большое воодушевление. Ведь теперь в принципе оказалось возможным выращивать клетки-заменители для лечения огромного числа заболеваний — от слепоты и диабета первого типа до болезни Паркинсона и сердечной недостаточности.
До развития этой новой технологии ученые испытывали огромные трудности при создании нужных клеток для лечения тех или иных болезней человека. Дело в том, что клетки, взятые у одного человека, обычно не удается спокойно имплантировать другому. Иммунная система распознает донорские клетки как чужеродные и уничтожает их, как если бы они являлись организмом-захватчиком. Однако, как показано на рис. 12.1, теперь мы в принципе имеем возможность производить клетки, идеально подходящие конкретному пациенту.
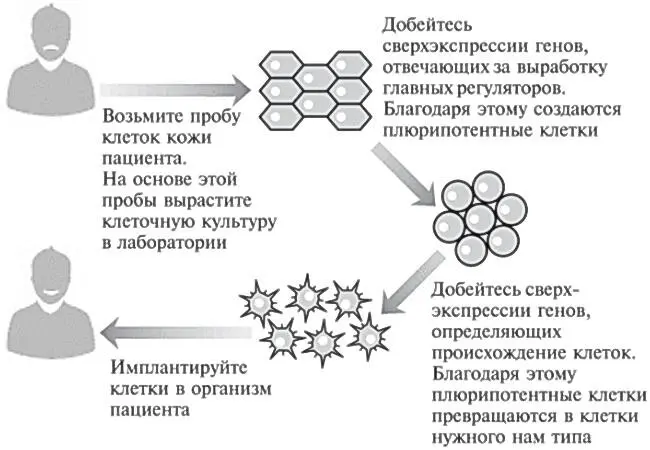
Рис. 12.1.Теория, в принципе позволяющая использовать клетки, выращенные на основе биоматериала пациента, для лечения этого конкретного пациента.Имплантируйте клетки в организм пациента.
На основе этой работы 2006 года возникла целая отрасль промышленности, потенциальный оборот которой составляет миллиарды долларов. Кроме того, исследователи получили одну из самых «быстрых» Нобелевских премий по физиологии и медицине: им присудили ее всего через 6 лет после первой публикации 15.
В нормальных ЭС-клетках некоторые белки, являющиеся главными регуляторами, при соединении с суперэнхансерами дают очень высокую плотность белков в зоне связывания. Сами же суперэнхансеры регулируют некоторые ключевые гены, поддерживающие плюрипотентное состояние клеток. В тех же местах очень высока концентрация комплекса-медиатора. Подавление экспрессии одного из главных регуляторов или медиатора оказывает весьма схожее воздействие на экспрессию этих ключевых генов. Уровни экспрессии падают, и увеличивается вероятность того, что ЭС-клетки начнут дифференцироваться, превращаясь в клетки специализированные.
Читать дальшеИнтервал:
Закладка:







![Надежда Алданен - Темные Материи [Dark Matters] II Заговор](/books/1158689/nadezhda-aldanen-temnye-materii-dark-matters-ii-z.webp)


