Амос Фрайс - Химическая война
- Название:Химическая война
- Автор:
- Жанр:
- Издательство:Государственное Военное Издательство
- Год:1924
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Амос Фрайс - Химическая война краткое содержание
Химическая война - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Горчичный газ кипит под атмосферным давлением при 215° — 217 °C, что ясно указывает на его большую стойкость, Хотя он перегоняется при этой температуре без разложения, но он очищается лучше при перегонке под уменьшенным давлением или при перегонке с водяным паром. Перегонный куб для горчичного газа под уменьшенным давлением описан Стритером [13] J. Ind. Eng. Chem. 11, 292 (1919 г.).
.
Совершенно чистый горчичный газ имеет температуру плавления 13° — 14 °C (летняя t° обычно 20° — 25 °C). Неочищенный продукт, получаемый непосредственно из реакционного аппарата, плавится при 9° — 10 °C. Для того, чтобы он оставался в снаряде жидким при зимней и летней температуре, немцы прибавляли к нему от 10 до 30 процентов хлор-бензола, позднее смесь хлор-бензола и нитро-бензола и, наконец, чистый нитро-бензол; употреблялся также четырех-хлористый углерод, как средство для предотвращения его перехода в твердое состояние. Много других смесей, как хлор-пикрин, синильная кислота, бром-ацетон и др. были испробованы, но не вошли в употребление.
Действие примесей на точку плавления горчичного газа указано в следующей таблице:
| Температура плавления смесей горчичного газа | |||
|---|---|---|---|
| % примеси | Хлор-пикрина | Хлор-бензола | Четырех-хлористого углерода |
| 0 | 13,4 °C | 13,4 °C | 13,4 °C |
| 10 | 9,8 °C | 8,4 °C | 9,8 °C |
| 20 | 6,3 °C | 6,4 °C | 6,6 °C |
| 30 | 2,6 °C | — 1,0 °C | — 3,1 °C |
Получаемый в Соединенных Штатах горчичный газ содержал в растворе от 17 до 18 процентов серы. Этот газ, заключенный в снаряд, употреблялся без прибавления какого-либо растворителя. На практике оказалось, что этот нечистый продукт причиняет значительно более острое заболевание, чем такое же количество чистого вещества, вследствие чего никакой первоначально предполагавшейся очистки более не производилось.
Удельный вес горчичного газа в жидком состоянии при 20 °C равен 1,2741. В твердом виде он имеет несколько больший удельный вес = 1,888 при 18 °C. Его давление пара при комнатной температуре очень низко: при 20 °C оно равно 0,06 м.м. ртутного столба.
Горчичный газ почти нерастворим в воде; насыщенный раствор его в воде содержит менее 0,1 %. Существуют указания на то, что был получен одно-процентный водный раствор, но при этом не был принят во внимание гидролиз. Горчичный газ свободно растворяется во всех обыкновенных органических растворителях, как-то в лигроине, спирте, эфире, хлороформе, уксусной кислоте, хлор-бензоле и т. д. В случае, если растворитель легко смешивается с водой, горчичный газ выделяется из него в виде масла.
Горчичный газ медленно разлагается при действии воды, вследствие своей незначительной растворимости. Продуктами распада являются ди-гидро-окси-этил-сульфид и соляная кислота:
(ClCH 2CH 2) 2+ S+ 2 H 2O = OH. СН 2CH2) 2S + 2HCl .
Некоторые сернистые масла повышают скорость гидролиза, увеличивая, с одной стороны, скорость перехода горчичного масла в раствор, с другой, усиливая его растворимость. Щелочи также повышают степень гидролиза. Окислители разрушают горчичный газ. Эта реакция была проведена в жизнь, применением порошка хлорной извести, как средства для уничтожения горчичного газа в поле (рисунок 9)
Хлор, двухлористая сера и другие хлорирующие вещества быстро превращают горчичный газ в бездеятельное (не нарывное) вещество. Двухлористая сера являлась ценным реактивом как в лабораториях, так и на заводах для очистки горчичного газа. Этой реакцией об'ясняются также первоначально неудачные попытки приготовления горчичного газа взаимодействием этилена и двухлористой серы. Горчичный газ, вероятно, образуется при этом, но почти моментально подвергается действию хлора, благодаря избытку двухлористой серы.
Однохлористая сера не действует на горчичный газ. Хлор-амин Т и ди-хлор-амин Т (ценные терапевтические средства, примененные Дэкином и Каррелем для лечения ран) также вступают в реакцию с горчичным газом.
По этой причине они были рекомендованы для лечения ожогов от горчичного газа, но, как мы увидим далее, не имели полного успеха.
Первоначально, единственным способом обнаружения горчичного газа было чувство обоняния. Тогда концентрации, которые не могли быть уловлены на запах, считались безвредными. Позднее это оказалось неверным, и явилась необходимость изобрести более тонкие методы исследования. Опыты, произведенные для этого в поле и в лаборатории, оказались не вполне удовлетворительными, так как были направлены на открытие хлора, содержащегося наравне с прочими галоидами в большинстве военных газов. Определение хлора лампой было основано на окислении медной сетки галоидом и последующем нагревании сетки на Бунзеновской горелке. Таким путем одну часть горчичного газа можно было обнаружить в 10 миллионах частей воздуха. Другой способ, рекомендованный Военно-Химический Службой, состоял в употреблении селеновой кислоты, но и здесь можно отметить полное отсутствие специфичности, потому что, в то время, как соединения, содержащие галоиды, не действуют на селен, мышьяковые и органические мышьяковые производные дают с ним положительную реакцию и часто в более короткое время, чем горчичный газ, Говорят, что у немцев были доски, покрытые желтым составом, обладающим способностью чернеть в присутствии горчичного газа. Эти доски опускались на дно только что захваченных траншей, и, если через несколько минут они становились черными; то можно было подозревать присутствие горчичного газа. Также сообщалось, что желтая краска для головной части снаряда с горчичным газом имела тот же состав и служила для обнаружения снаряда, давшего течь. Однако, из допроса одного немецкого дезертира явствует, что доверие, возлагаемое на эти реактивы, было неосновательным и приводило иногда к несчастным случаям.
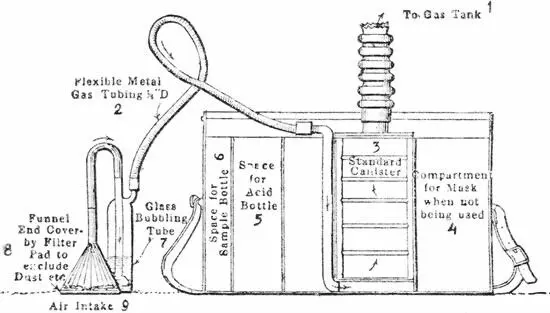
Рис. 36
Полевой прибор для обнаружения горчичного газа.
1. К резервуару с газом.
2. Гибкая металлическая газовая трубка.
3. Нормальный патрон-респиратор.
4. Отделение для маски.
5. Место для сосуда с кислотой.
6. Место для сосуда с пробой.
7. Дрексель.
8. Основание воронки, закрытое фильтром для задержания пыли и пр.
9. Вход воздуха.
Существовала также белая краска, становившаяся в присутствии горчичного газа красной, но перемена цвета не была характерна для испытуемого вещества, так как опыты, сделанные в нашей армии, показали, что и другие масла (анилин, скипидар, льняное масло) производят то же самое действие.
Отделам Военно-Химической Службы удалось составить эмалевую и масляную краску, которые были очень чувствительными реактивами на горчичный газ. Обе краски были желтого цвета и при соприкосновении с газом становились темно-красными. Перемена окраски происходила мгновенно. Эмалевая краска состояла из желтого хрома, как пигмента, смешанного с красным маслом и целулоидным лаком (раствором нитроклетчатки в амило-уксусном эфире). Один галлон эмали покрывает 946.500 кв. см. или пояски шириной в 3 см. на 12.500 7-сант. снарядах. Масляная краска состояла из 50 % сырого льняного масла и 50 % японского сиккатива, к каковой смеси добавлялась выше-описанная эмаль в требуемом количестве. При соприкосновении с жидким горчичным газом, эта краска переходит в 4 секунды в темно-малиновый цвет, с мышьяковыми производными становится пурпурной или темно-зеленой, при чем перемена цвета почти мгновенная и очень чувствительная даже к парам этих составов. Другие вещества не оказывают на окраску никакого влияния.
Читать дальшеИнтервал:
Закладка:









