Михаил Ермолаев - Биологическая химия
- Название:Биологическая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1974
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Ермолаев - Биологическая химия краткое содержание
В учебнике нашли отражение последние научные данные о ферментах, белках, гормонах, обмене веществ и энергии и т. д. Особое внимание обращено на значение и использование данных биохимии в медицине, в связи с чем расширены разделы, посвященные патологии разных видов обменов и их исследованиям в клинике Включены материалы по наследственным заболеваниям, связанным с нарушением синтеза белка и ферментов.
Учебник написан по программе, утвержденной Министерством здраво" хранения СССР, и предназначен для учащихся фельдшерско-лаборантских отделениях медицинских училищ.
Биологическая химия - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
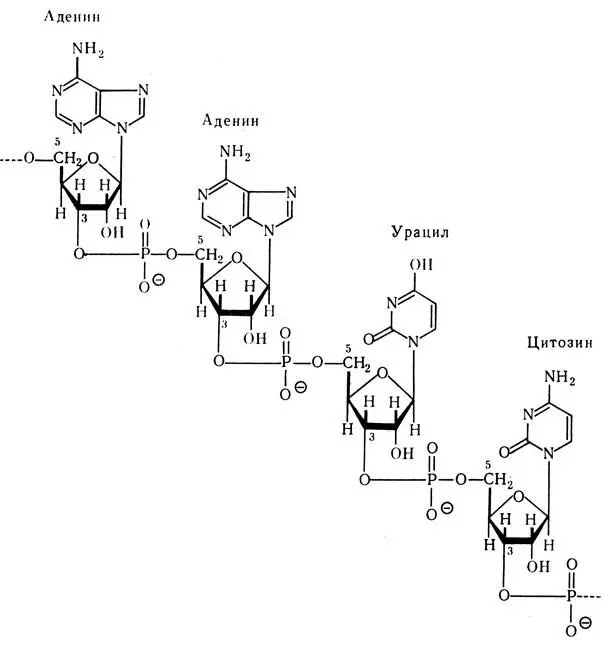
Первичная структура РНК
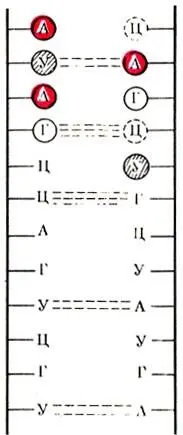
Рис. 20. Схема водородных связей на участке вторичной структуры молекулы РНК
В составе РНК обнаружены фосфорная кислота, из углеводов — рибоза вместо дезоксирибозы в ДНК и азотистые основания — аденин, гуанин, цитозин и урацил (в ДНК — тимин) — А, Г, Ц и У. Первичная структура РНК одинакова с первичной структурой ДНК и представляет собой последовательное соединение мононуклеотидов при помощи фосфоэфирных связей. Вторичная структура РНК представляет собой участки первичной структуры, перекрученные между собой в виде спирали, которые удерживаются за счет водородных связей, образованных между азотистыми основаниями по принципу комплементарное, т. е. А — У и Г — Ц. Таким образом, существует различие с ДНК, где вместо тимина к аденину присоединяется урацил (рис. 20), Третичная структура РНК — это пространственное расположение всей молекулы РНК (рис. 21).
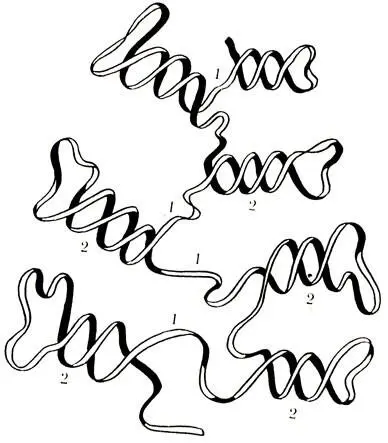
Рис. 21. Участок третичной структуры молекулы РНК. 1 — участки первичной структуры, 2 — участки вторичной структуры
Хромопротеиды
Небелковая часть этих сложных белков представлена окрашенными соединениями Представителями хромопротеидов в животном организме являются гемоглобини миоглобин, а в растительных клетках — хлорофилл.К группе хромопротеидов относятся некоторые ферменты, например каталаза и пероксидаза крови. Приоритет в изучении химической природы красящего вещества гемоглобина принадлежит М. В. Ненцкому. Гемоглобин состоит из белка основного характера — глобина и небелковой части — гема , в составе которого имеется атом двухвалентного железа. В молекуле гемоглобина обнаружено 4 гема.
Гемоглобин (Нb) в организме может находиться в разных формах. Оксигемоглобин — НbO 2— характеризует важнейшую биологическую функцию гемоглобина — снабжение клеток организма кислородом. Присоединение кислорода к гемоглобину происходит за счет специфических (координационных) связей с железом. При этом окисления железа не происходит и оно остается двухвалентным. Такая связь является весьма непрочной и легко разрывается при изменении парциального давления. Присоединение кислорода к гемоглобину происходит в легких, откуда кровью НbO 2разносится ко всем органам и тканям, где кислород освобождается и используется клетками. Гемоглобин же присоединяет к себе один из конечных продуктов обмена веществ, в клетках — углекислый газ — и транспортирует его к легким. Здесь СO 2отщепляется и выводится из организма при дыхании. Освободившийся гемоглобин вновь присоединяет кислород и процесс транспорта газа повторяется.
Соединение гемоглобина с угарным газом — СО называется карбоксигемоглобином — НbСО. НbСО образуется при отравлении организма угарным газом и намного прочнее связывается с гемоглобином, чем кислород, и выключает таким образом гемоглобин из транспорта кислорода. Соответственно к органам и тканям поступает меньше кислорода, в результате чего возникает кислородное голодание, а снижение поступления кислорода к мозгу приводит к потере сознания.
При окислении гемоглобина окислителями валентность железа изменяется и оно становится трехвалентным, а гемоглобин превращается в метгемоглобин — HbOH.
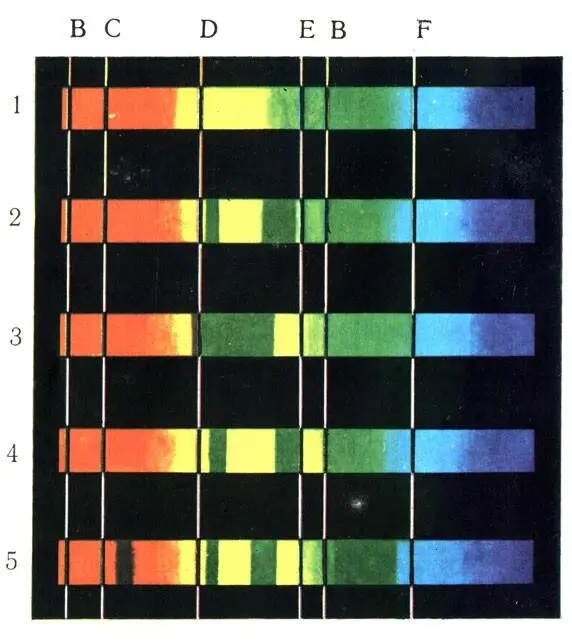
Рис. 22. Спектры поглощения. 1 — солнечный спектр; 2 — оксигемоглобин; 3 — гемоглобин; 4 — карбоксигемоглобин; 5 — метгемоглобин
Одним из методов распознавания производных гемоглобина является исследование их спектров поглощения. Как установлено, при прохождении луча белого света через призму он разлагается на ряд цветных лучей, видимых на экране, от красного до фиолетового, что дает известную картину спектра, как, например, радуга. Если на пути луча между источником света и призмой поместить раствор с веществом, способным к поглощению луча с определенной длиной волны, то в определенных местах должны появиться темные, неосвещенные участки. Такой спектр называется спектром поглощения (рис. 22). Сам гемоглобин (рис. 22, 3) дает одну широкую темную полосу между линиями D и Е. НbО 2(рис. 22, 2) в этих же границах дает две темные линии, и НbCO (4) и НbОН (5) показывают свои специфические спектры поглощения.
Миоглобин — хромопротеид мышц — дыхательный пигмент мышц. Особенностью миоглобина является его более легкая способность присоединять кислород и значительно труднее по сравнению с гемоглобином его отдавать. Миоглобин создает запасы кислорода в мышцах, количество которого может достигать 14% всего кислорода организма. Это имеет важное значение, особенно для деятельности мышцы сердца. В мышцах морских животных (тюлень, морж, кашалот) высокое содержание миоглобина позволяет им длительное время находиться под водой, несмотря на отсутствие жабер.
Глюкопротеиды
Это сложные белки, простетическая группа которых представлена производными углеводов, среди которых встречаются аминосахара, гексуроновые кислоты и др. В составе отдельных глюкопротеидов обнаружены остатки серной и уксусной кислот Глюкопротеиды составляют основу муцинов — слизистых веществ, которые встречаются в большом количестве в секретах желудочно-кишечного тракта, подчелюстной слюнной железы.
Фосфопротеиды
Соединения этого класса сложных белков характеризуются наличием фосфорной кислоты. Представителями являются казеиноген молока, вителлин — белок, выделенный из желтков яиц, ихтулин — белок рыбьей икры и др. Фосфопротеиды являются питательным материалом для растущих организмов.
Липопротеиды
Липопротеиды представляют собой комплексные соединения белка и различных жиров (холестерина, нейтрального жира, фосфолипидов и др.). У растворимых липопротеидов белковая часть расположена на поверхности молекулы. В организме различные их фракции, например α- и β-липопротеиды, обнаружены в составе плазмы крови, нервной ткани, а также в яичном желтке, молоке.
Одной из основных функций липопротеидов является транспорт жира.
Концентрация липопротеидов в сыворотке крови меняется при отдельных заболеваниях, поэтому их определение имеет диагностическое значение, как, например; при атеросклерозе, когда увеличено содержание β-липопротеидов.
Читать дальшеИнтервал:
Закладка:









