Михаил Супотницкий - Эволюционная патология
- Название:Эволюционная патология
- Автор:
- Жанр:
- Издательство:Вузовская книга
- Год:2009
- Город:Москва
- ISBN:978-5-9502-0378-7
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Супотницкий - Эволюционная патология краткое содержание
Книга рассчитана на широкий круг читателей. Особенно полезной она будет для исследователей, интересующихся фундаментальными проблемами патогенеза и эпидемиологии новых инфекционных болезней, для студентов биологических и медицинских факультетов вузов, а также для врачей-инфекционистов и эпидемиологов.
Книга издана в авторской редакции.
Эволюционная патология - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Вставки Alu-экзонов вводят преждевременные терминальные кодоны или рамки считывания, а сами Alu-элементы генома человека действуют как очень большой резервуар альтернативных экзонов. В большинстве случаев экзонизированные последовательности являются либо нейтральными мутациями, либо проявляются вредным действием для отдельной особи, но это их влияние на особь незначительно, так как новый альтернативный продукт сплайсинга составляет только небольшую часть продукта обычного сплайсинга зрелой мРНК.
A — I редактирование . Редактирование РНК — процесс, посредством которого нуклеотидные последовательности молекул РНК изменяются во время транскрипции и после нее. Модификация РНК включает нуклеотидные вставки и делеции, и модификации оснований. Наиболее эффективным приемом модификации оснований является реакция гидролитического деаминирования, посредством которой цитозин конвертируется в урацил; а аденозин (А) в инозин (I), другое название процесса — A — I редактирование. Эта реакция в условиях in vivo катализируется ферментами семейства аденозиндезаминаз (adenosine deaminase, ADAR), предпочтительно редактирующих аденозин, расположенный в двуцепочечном регионе молекулы РНК (Valente L., Nishikura K., 2005) (рис. 15).
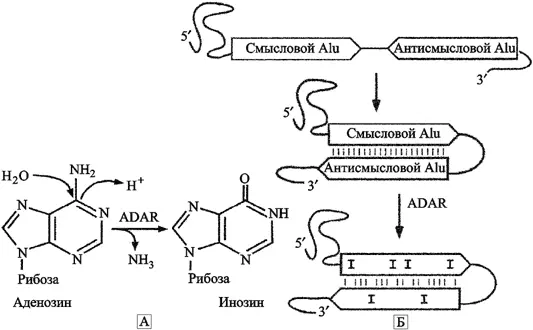
A. Реакция деаминирование аденозина через ADAR, ведущая к образованию инозина. Б. Внутримолекулярное спаривание оснований двух мРНК, содержащих Alu-элементы в противоположной ориентации. Спаривание оснований двух Alu-элементов приводит к формированию длинного стабильного двунитевого РНК-региона, в котором ADAR выполняет замену A на I. Редактирование является удачным, когда дистанция составляет <2 кб разделенными двумя Alu-элементами в противоположной ориентации. Два близко вставившихся Alu-элемента становятся идеальным субстратом для ADAR (по Hasler J. и Strub K., 2006).
Точная роль A — I редактирования в метаболизме клеток неизвестна, но она жизненно необходима для реализации клеточного цикла. Было показано, что нокаут (knockout — выбивать, испортить) гена ADAR1 эмбрионов мышей приводит к летальному эффекту через разрушение печени (Hartner J. C. et al., 2004). Замена A на I является широко распространенным механизмом редактирования РНК. Более 90 % всех A — I замен происходят в пределах Alu-элементов, содержащихся в мРНК. Установлено что A — I редактирование предпочтительно встречается в некодирующих регионах мРНК. А так как ADAR-ферменты не являются специфичными для двунитевой РНК определенных сайтов, то граничащие с Alu основания также часто подвергаются редактированию.
РНК-редактирование может серьезно воздействовать на экспрессию генов на отдельных этапах жизненного цикла клетки. Так как инозин не может спариваться с урацилом, а только с цитозином, то редактирование может воздействовать на стабильность молекулы РНК посредством создания и разрушения вторичных структур. Когда инозин будет распознан как гуанозин, то посредством аппарата трансляции и сплайсинга A — I редактирование способно привести к аминокислотным заменам в кодирующей последовательности, или к модификации сайта сплайсинга в интроне, приводя к преждевременной терминации транскрипции или к искажению рамки считывания гена белка.
Участие в трансляции белков . С начала 1990-х гг. известно, что Alu РНК, транскрибированная с ДНК Alu-элементов, постоянно представлена в цитозоле клеток приматов. Хотя Alu-элементы и содержат внутренние A и B боксы промотора РНК полимеразы III, но этот внутренний промоторный элемент слишком слаб для осуществления эффективной транскрипции Alu-элементов. В обычных условиях Alu РНК представлена в очень низком количестве копий в цитозоле (10 3–10 4молекулы на клетку). В стрессовых же условиях, таких как вирусная инфекция, экспозиция циклогексемидом или тепловой шок, уровень их экспрессии значительно увеличивается. Alu-элементы имеют высокий потенциал модуляции генной транскрипции посредством связывания отдельных транскрипционных факторов. Alu РНК выполняет какую-то специфическую функцию в клеточном метаболизме, и необходима для выживания клетки в условиях стресса, а транскрибируемая с ДНК Alu-элементов «утиль РНК» («junk RNA») участвует в процессах клеточного метаболизма. Первичные Alu-элементы были не более чем «эгоистичной ДНК» (см. «Проретроэлементы и проретровирусы»), но давление естественного отбора адаптировало их в геноме через закрепление за ними важных функций в регуляции генной экспрессии. Этот выигрыш регуляционной функции, известный как экзаптация (exaptation), участвовал в эволюции приматов по типу кладогенеза и помог их дивергенции среди других млекопитающих (Brosius J., Gould S. J., 1992).
ARE . Значительная часть мРНК млекопитающих в 3'-нетранслируемых регионах (untranslated regions, UTR) представлена последовательностями, содержащими аденин-урацил-обогащенные элементы (adenine and uracil rich elements, AREs). Такие мРНК-последовательности обычно стабильны. Однако в последние годы обнаружены их разновидности, производные от Alu, уменьшающие стабильность мРНК и приводящие ее к распаду. Alu-повторы составляют до 5 % 3' UTR последовательностей мРНК. На рис. 16 показан возможный механизм образования ARE.
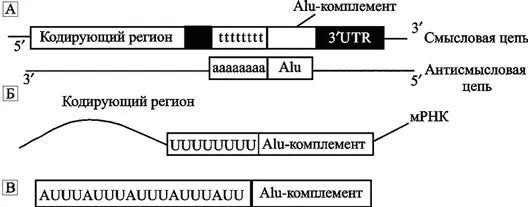
A. Alu содержат poly-adenine (poly-A) — регион в концевой части. На схеме он показан как «aaaaaaaa» (также см. рис. 10). Poly-A Alu в антисмысловой ориентации становится poly-T (комплементарной poly-A) в смысловой цепи ДНК. Эта последовательность показана как «tttttttt». Б. Теперь, после транскрипции poly-T-региона, мРНК содержит poly-uracile (poly-U) — регион. В. AU-обогащенные элементы находят именно в этих poly-U-регионах (B) (по Hyeong Jun An et al., 2004).
Hyeong Jun An et al. (2004) обнаружили, что не менее половины наиболее протяженных ARE являются производными от (poly-T) — регионов, комплементарных (poly-A) — регионам Alu. Они предположили, что Alu не только участвуют в экспрессии 5'-генов и, в альтернативном сплайсинге интронных регионов генома, но и перемещаясь по геному через ретропозицию (см. «Эволюционная роль L1 ретроэлементов»), они способны увеличивать или сокращать период полураспада мРНК (особенно в области 3' UTR) через образование ARE. Это еще один и, видимо, далеко не последний, из механизмов воздействия на экспрессию отдельных генов, обусловленный активностью ретроэлементов.
Эволюционная роль ретропсевдогенов. В геноме человека имеется более 20 тыс. псевдогенов — «молчащих» копий известных генов. «Ретропсевдогенез» — это процесс образования псевдогенов через обратную транскрипцию с мРНК. Вследствие утраты регуляторных элементов ретропсевдогены почти всегда функционально неактивны, начиная с того самого времени, когда они впервые внедрились в хромосомную ДНК. По этой причине они обычно не подвергаются природной селекции и, следовательно, являются идеальным объектом для изучения нейтральной эволюции (Csuros M., Miklos I., 2005). Например, по нуклеотидным различиям в псевдогенах цитохрома С. Grossman et al. (2001) показали ускоренную эволюцию этого белка в период формирования предка человекоподобных приматов 40 млн лет назад.
Читать дальшеИнтервал:
Закладка:








![Михаил Супотницкий - Очерки истории чумы. Книга II. Чума бактериологического периода [без иллюстраций]](/books/1084186/mihail-supotnickij-ocherki-istorii-chumy-kniga-ii.webp)
![Михаил Супотницкий - Очерки истории чумы. Книга I. Чума добактериологического периода [без иллюстраций]](/books/1084187/mihail-supotnickij-ocherki-istorii-chumy-kniga-i-ch.webp)
