Михаил Супотницкий - Эволюционная патология
- Название:Эволюционная патология
- Автор:
- Жанр:
- Издательство:Вузовская книга
- Год:2009
- Город:Москва
- ISBN:978-5-9502-0378-7
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Супотницкий - Эволюционная патология краткое содержание
Книга рассчитана на широкий круг читателей. Особенно полезной она будет для исследователей, интересующихся фундаментальными проблемами патогенеза и эпидемиологии новых инфекционных болезней, для студентов биологических и медицинских факультетов вузов, а также для врачей-инфекционистов и эпидемиологов.
Книга издана в авторской редакции.
Эволюционная патология - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
В настоящее время накоплено уже достаточно данных, позволяющих утверждать, что ретротранспозируемые элементы и ретровирусы активно проявили себя в эволюции приматов-гоминоидов. Эволюционные процессы с их участием не только начались задолго до образования современных видов гоминоидов, но они создали определенный генетический «задел на будущее», предопределяя альтернативы дальнейшей эволюции человека в рамках своего систематического класса и вне зависимости от его собственных намерений. Эндогенизация ретровирусов происходила на фоне массовых эпизоотий, сопровождавшихся вымиранием отдельных видов приматов, в том числе и гоминоидов. У предков шимпанзе и предков человека уже не менее 5 млн лет функционируют разные эндогенные ретроэлементы с разными сценариями активности. Одному из таких «сценариев» вид Homo sapiens обязан своим происхождением в качестве «мыслящего». Процессы образования псевдогенов и прекращения инвазии транспозируемых элементов представляют собой некую «систему сдержек и противовесов» ретровирусной эволюции.
1.3. Ретровирусное окружение вида Homo sapiens
Структура и цикл жизни ретровирусов. Онкогенные ретровирусы (Oncovirinae). Лентивирусы (Lentivirinae, «медленные вирусы»). «Пенящиеся вирусы» (Spumavirinae). Инфицированность лентивирусами диких животных. Непатогенная инфекция. Реинтеграция и реинфекция ретровирусов. Коинфекция.
Когда знакомишься с вирусологической литературой, изданной «накануне» обнаружения ВИЧ, то складывается впечатление, что ретровирусы на тот момент были изучены не хуже, чем кишечная палочка (см., например, работы Альштейна А. Д., 1982; Тимакова В. Д. и Зуева В. А., 1977).
Первые ретровирусы открыты еще в начале ХХ столетия, когда была установлена вирусная природа эритробластоза и саркомы кур. Вскоре были обнаружены вирус рака молочных желез мышей и вирус лейкоза мышей. Название семейству дано в 1973 г. W. Parks — оно происходит от англ. «reverse transcriptase» (обратная транскриптаза). В латинском варианте «retro» означает обратный поток информации — не от ДНК к РНК, а, наоборот, от РНК к ДНК. В 1970-х гг. семейство было тщательно классифицировано и изучено. Установлена морфология, химический состав, жизненный цикл и патогенные свойства многих его представителей. Ретровирусы были обнаружены как у животных, составляющих ближайшее окружение человека, так и у его эволюционных предков. Их выявили у норок (эндогенный вирус типа С), мышей (экзогенные и эндогенные вирусы лейкоза, вирус саркомы, вирусы рака молочных желез), крыс (эндогенный вирус типа С), хомяков (эндогенный вирус типа С), кошек (эндогенный вирус типа С, экзогенные вирусы лейкоза и саркомы), крупнорогатого скота (вирус лейкоза), обезьян (эндогенные и экзогенные вирусы типа С, эндогенный вирус типа В, вирус лимфомы гиббонов и др.), свиней (вирус типа С), у пресмыкающихся (вирусы типа С), овец (вирусы висны) и др. «Рука ученого» дотянулась даже до ретровирусов гадюк. Тем более удивительным нам представляется существовавший на тот момент пробел в знаниях по ретровирусам у людей. На этом фоне и так запоздалое обнаружение ВИЧ выглядит до сих пор чуть ли не «как гром с ясного неба», даже роль этого вируса в развитии пандемии СПИДа подвергается сомнению.
Структура и цикл жизни ретровирусов.Ретровирусы — семейство сложных РНК-геномных вирусов, образующих с помощью обратной транскриптазы ДНК-копию генома, которая, интегрируя с геномом хозяина, вызывает интегральную инфекцию. Для включения вируса в семейство Retroviridae обязательны следующие признаки:
1) наличие липидной оболочки и сердцевины (core) и характерная морфология, на основании которой их делят на типы В, С и D;
2) наличие обратной транскриптазы внутри вириона;
3) геном в виде однонитевой линейной РНК, которая образует комплекс, состоящий из двух идентичных субъединиц (т. е. они представляют собой диплоидные организмы, каждый их вирион содержит две идентичные цепи РНК размером от 8 тыс. до 10 тыс. нуклеотидов, соединенных вблизи своих 5’-концов);
4) репликация через стадию образования двунитевого ДНК-провируса, соответствующего по длине одной из субъединиц геномной РНК;
5) интеграция ДНК-провируса с клеточным геномом и осуществление транскрипции клеточной РНК-полимеразой (после интеграции ретровирусная ДНК реплицируется как часть клеточной ДНК), созревание вириона путем почкования на клеточных мембранах (Альштейн А. Д., 1982).
Вирион сферический (диаметр 80-100 нм) оболочечный, с гликопротеиновыми поверхностными выступами (8 нм в длину). Внутреннее ядро включает сферический нуклеокапсид (нуклеоид), расположенный эксцентрично у представителей рода Betaretrovirus, по центру — у Alpharetrovirus, Gammaretrovirus, Deltaretrovirus и Spumavirus, и в виде стержня или усеченного конуса у представителей рода Lentivirus. Традиционно семейство разделяют на подсемейства ленти-, онкорна- и спумавирусов (Dalton F. et al., 1974; Matthews R., 1979). Ретровирусное филогенетическое древо показано на рис. 17.
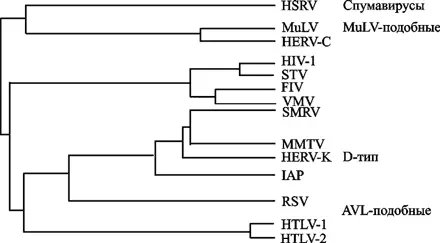
На филогенетическом дереве показаны ретровирусы типа С [вирусы лейкозов грызунов (MuLV) и птиц (АLV), а также вирус, тропный к Т-лимфоцитам человека (НТLV)], лентивирусы [вирусы иммунодефицита человека (ВИЧ-1 и 2), обезьян (SIV), кошек (FIV) и вирус visna-maedi (VMV)], спумавирусы и эндогенные ретровирусы человека (HERV-K и HERV–C) (Пауэр К., 2001).
Схематическое изображение РНК-генома ретровирусов приведено на рис. 18.
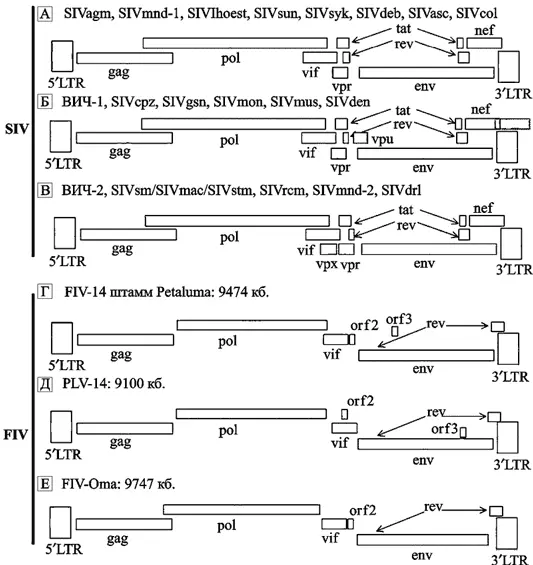
Лентивирусы приматов обладают пятью регуляторными генами (vif, rev, tat, vpr и nef), которые обычно «выстроены в шеренгу» в одних и тех же регионах SIV/ВИЧ генома. Гены tat и rev содержат по два экзона. Присутствие в геноме лентивируса двух других регуляторных генов (vpx и vpu) варьирует в зависимости от происхождения вируса. Их сочетания обычно делят на три геномные групы: а) SIVsyk, SIVasc, SIVdeb, SIVblu, SIVtal, SIVagm, SIVmnd-1, SIVlhoest, SIVsun и SIVcol содержат пять добавочных генов (tat, rev, nef, vif и vpr); b) геномы ВИЧ-1, SIVcpz, SIVgsn, SIVmus, SIVmon и SIVden включают дополнительный ген vpu; c) ВИЧ-2, SIVsmm, SIVmac, SIVrcm, SIVmnd-2 и SIVdrl формируют третью геномную группу, характеризующуюся присутствием гена vpx.Гены far, vpx специфичны для SIV, инфицирующих обезьян Papionini (триба павиановые, включают следующие рода: павианы, макаки, мангобеи, мандрилы, джелады) и были приобретены в результате негомологичной рекомбинации (nonhomologous recombination), которая привела к дупликации гена vpr. SIVblu, SIVolc, SIVwrc, SIVasc, SIVbkm, SIVery и SIVagi не были полностью секвенированы, и поэтому пока нет возможности охарактеризовать организацию их генов. Структура геномов трех видов FIV сходна и не обнаруживает явных геномных групп, связанных с патогенностью для кошачьих. FIV несут два других добавочных гена: ген dUTPазы (dUTPase gene; на схеме не показан), расположенный в рамке в пределах гена pol. Он ответственен за предотвращение ошибочного включения урацила (uracil misincorporations) в молекулу РНК вируса во время его репликации и, соответственно, его аттенуации. Вторая открытая рамка считывания, обозначенная как orf-A (также ее называют orf-2), кодирует протеин, состоящий из 77 аминокислот, сходный с Tat ВИЧ. У этого протеина не обнаружена способность к трансактивации (transactivating properties), однако он является критическим на ранней стадии инфицирования клетки и при формировании вирусной частицы, локализован в ядре, что делает его более сходным по свойствам с Vpr. Нарушение функции белка Orf-A ведет к снижению способности вируса к репликации и уменьшению его патогенности. Оrf-3 содержит ATG-кодон в направлении «вниз» (downstream) от потенциального сплайсингакцепторного сайта. кб — килобазы.
Читать дальшеИнтервал:
Закладка:








![Михаил Супотницкий - Очерки истории чумы. Книга II. Чума бактериологического периода [без иллюстраций]](/books/1084186/mihail-supotnickij-ocherki-istorii-chumy-kniga-ii.webp)
![Михаил Супотницкий - Очерки истории чумы. Книга I. Чума добактериологического периода [без иллюстраций]](/books/1084187/mihail-supotnickij-ocherki-istorii-chumy-kniga-i-ch.webp)
