Жан-Поль Эймишен - Электроника?.. Нет ничего проще!
- Название:Электроника?.. Нет ничего проще!
- Автор:
- Жанр:
- Издательство:Энергия
- Год:1975
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Жан-Поль Эймишен - Электроника?.. Нет ничего проще! краткое содержание
Книга в занимательной форме знакомит читателя со многими областями одной из наиболее быстро развивающихся в настоящее время наук — электроники. Рассказывается о возможностях использования электроники в промышленности.
Книга рассчитана на широкий круг читателей.
Электроника?.. Нет ничего проще! - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Н. — Этот метод представляется многообещающим.
Л. — У меня нет времени, а то я рассказал бы тебе об обнаружении изъянов в толще металла, об очистке, о медицинских и многих других областях использования радиоактивных изотопов. В заключении этого раздела я хочу рассказать тебе о преобразователях, чувствительных к химическому — воздействию.
Н. — Но в химии я не так-то силен.
Л. — Беда не велика. Тебе сейчас достаточно лишь знать, что химические реакции представляют собой не что иное, как электрические взаимодействия между различными ионами (сейчас я говорю только о химии растворов). Кислотой называют вещество, которое в растворе освобождает водородные ионы Н +, т. е. водородные атомы, потерявшие свой электрон.
Н. — Следовательно, это протоны.
Л. — Совершенно верно. И эти протоны горят желанием возвратить утерянный электрон, и чаще всего они забирают его у отрицательных ионов, обладающих избытком электронов. Например, в растворах имеются ионы, именуемые гидроксильной группой ОН -, состоящие из одного атома кислорода, одного атома водорода и одного лишнего электрона. Эти ионы стремятся соединиться с ионами Н +.
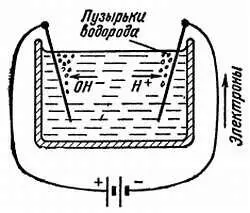
Рис. 34. Если к двум опущенным в воду электродам приложить разность потенциалов, то ионы Н +направятся к катоду, где получат недостающий им электрон и превратятся в водород. Это явление называется электролизом (ионы ОН -отдают свой заряд на аноде и разлагаются с выделением кислорода).
Н. — и что получается в результате?
Л. — Просто-напросто вода Н 2О — нейтральное соединение. Молекулы воды в свою очередь имеют некоторую тенденцию распасться на ионы Н +и ОН -, но таких молекул крайне мало: чистая вода очень плохо проводит электрический ток.
Протекающую реакцию записывают следующим образом:
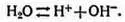
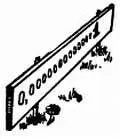
Двойная стрелка обозначает, что реакция может протекать в обоих направлениях, но происходит она преимущественно в направлении справа налево. На основе одного химического закона можно доказать, что произведение количества содержащихся в воде ионов Н +(концентрация, обозначается | Н +|) на количество содержащихся в воде ионов ОН -(обозначается | ОН -|) всегда постоянно и равно | Н +| х | ОН -| = 10 -14.
Н. — В самом деле, не очень много! Это составляет одну стотысячную одной миллиардной! Как же обозначают цифрами такие концентрации?
Л. — Их выражают в «грамм-ионах на литр» (г·ион/л), т. е. числом, показывающим, сколько раз 1 г ионов Н +или 17 г ионов ОН -содержится в литре (что соответствует 6·10 23настоящих ионов). Само собой разумеется, что взвесить ионы нельзя, так как нет возможности получить их в свободном состоянии. Но их количество можно определить косвенными методами. Например, можно возвратить ионам Н +недостающие им электроны, в результате чего получится газ водород (рис. 34), объем которого можно замерить, а это даст нам и вес (примерно 1 г на 11 л).
Н. — По твоему уравнению диссоциации количество ионов Н +должно точно соответствовать количеству ионов ОН -. Разве не так?
Л. — Да, если бы я не добавил в воду постороннее вещество. Ну и раз ты находишься на верном пути, скажи мне, какова концентрация ионов Н +в чистой воде.

Н. — Это можно рассчитать. Если | Н +| = | ОН -|, а их произведение равно 10 -14, то концентрация каждого из названных ионов составляет 10 -7.
Л. — Прекрасно. Если теперь я добавлю в воду кислоту, которая высвобождает большое количество ионов Н +, то концентрация ионов ОН -снизится, потому что произведение | Н +| х | ОН -| остается равным 10 -14. Чем больше ионов Н +, тем более выраженный кислотный характер приобретает раствор. Теперь принято измерять количество ионов Н +в растворе и обозначать его логарифмом в сопровождении значка Н +, эту величину называют водородным показателем pH раствора.
Н. — О! Опять логарифмы! Они приводят меня в ужас.
Л. — Все это не так страшно. Запомни только логарифмы некоторых чисел:

Н. — Значит, логарифм всего лишь показатель степени числа 10?
Л. — Видишь, ты сам это понял. Когда говорят, что pH раствора, например, 6, это означает, что концентрация ионов Н +в этом растворе составляет 10 -6. Ты знаешь, что очень чистая вода имеет показатель pH, равный 7. У кислых растворов показатель pH меньше 7…

Н. — Нет, ты ошибаешься! В кислых растворах концентрация ионов Н +выше.
Л. — Подожди, Незнайкин, разве ты не согласен, что 10 -2(или 0,01) все же больше, чем 10 -7(или 0,0000001)?
Н. — Согласен, ты прав. Но скажи, пожалуйста, до какого уровня может опуститься показатель pH в очень кислых растворах?
Л. — При pH = 0 в растворе в каждом литре содержится 1 грамм-ион Н +. А так как концентрация этих ионов может быть немного выше, то величина pH может спуститься несколько ниже нуля — почти до —1.
И наоборот, в основных (или щелочных) растворах, куда добавили ионов ОН -, концентрация ионов Н +опускается ниже уровня 10 -7и может дойти до 10 -14(когда на каждый литр раствора приходится 1 грамм-ион ОН -) и показатель pH может достичь 14.
Иногда показатель может еще повышаться почти до 15, но эти случаи носят скорее характер исключения, чем правила.

Н. — Но тогда величину pH совершенно невозможно измерить?
Л. — Почему ты думаешь, что при высоких значениях pH, иначе говоря у щелочных растворов, труднее измерить этот показатель?
Н. — Да потому, что даже с помощью точных измерительных приборов невозможно измерить количество ионов, когда в литре их всего лишь 10 -12или того меньше.
Читать дальшеИнтервал:
Закладка:








