Михаил Никитин - Происхождение жизни. От туманности до клетки
- Название:Происхождение жизни. От туманности до клетки
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2016
- Город:Москва
- ISBN:978-5-9614-4350-9
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Никитин - Происхождение жизни. От туманности до клетки краткое содержание
Происхождение жизни. От туманности до клетки - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Кстати, и сейчас есть генетические элементы, которые сочетают полезные для клетки гены и почти вирусные приемы распространения. Многие бактериальные плазмиды [12]несут полезные для клетки гены, например гены устойчивости к антибиотикам. Наряду с полезными генами у них бывает система токсин-антитоксин: два гена, кодирующие два белка. Один белок ядовит для клетки и устойчив, другой работает противоядием, но быстро разлагается. В случае потери плазмиды клетка лишится противоядия, а запас устойчивого яда ее убьет. В результате плазмида устойчиво сохраняется в клетках даже в тех условиях, когда ее гены бесполезны для клетки.
Если каждая из частей генома сама может позаботиться о своем будущем и в виде вирусоподобной частицы перепрыгнуть в те «организмы-сообщества», которые ее не унаследовали, то возможно устойчивое воспроизведение генома из десятков и сотен отдельных молекул. В этом случае даже на основе чистой РНК можно вместить в одном организме более 1000 генов. Кстати, разные части генома при этом не обязаны иметь одинаковый химический состав и механизмы копирования. С тем же успехом сегментарный геном LUCA может сочетать ДНК и РНК.
Мир вирусов и переход от РНК к ДНК
Мы видим, что история предков клеток предположительно тесно переплетена с историей вирусов. Многие биологи отказывали вирусам в праве называться «живыми» потому, что в вирусной частице нет обмена веществ. Однако споры бактерий и грибов тоже до попадания в благоприятные условия останавливают обмен веществ. Даже лягушку можно заморозить в жидком азоте с полной остановкой всех биохимических реакций, но после размораживания она оживет. Вирусная частица (вирион) – это просто покоящаяся стадия жизненного цикла вируса. Крупнейший вирусолог Патрик Фортер предлагает считать основной стадией жизни вируса его активный этап жизни, проходящий в зараженной клетке. Многие вирусы при этом образуют «вирусные фабрики» – особые структуры, сочетающие в себе клеточные и вирусные белки и собирающие новые вирусные частицы. «Вирусные фабрики» и в целом зараженные клетки («вироклетки», как предлагает их называть Фортер), естественно, имеют обмен веществ и, без сомнения, могут называться живыми. При этом они находятся под контролем вирусного генома и производят новые вирусные частицы, а не новые копии клетки, т. е. это, безусловно, живая стадия вируса.
Эволюционная биология долго пренебрегала вирусами, и лишь в последние годы они получили признание как важнейшие агенты горизонтального переноса генов, создатели принципиально новых генов и партнеры по «гонке вооружений» со всеми клеточными организмами. Эта революция подробнее описана, например, у Евгения Кунина в книге «Логика случая. О природе и происхождении биологической эволюции» (М., 2014).
Вирусы, по-видимому, существуют со времен РНК-мира. Существует огромное их разнообразие – одно– и двухцепочечные ДНК-вирусы, ретровирусы, одно– и двухцепочечные РНК-вирусы. Механизмы их репликации очень разные, и не всегда понятно, как одни могли произойти из других. Однако есть несколько характерных генов, которые встречаются во всех классах вирусов и совершенно отсутствуют в клеточных организмах. Это JRC (так называемый рулет с вареньем, jelly-roll capsid protein) – один из типов белков вирусных оболочек, хеликаза S3H, запускающая копирование разных типов вирусных геномов, и упаковочная АТФаза, переносящая ДНК и РНК в собранные белковые оболочки с затратой АТФ. Широкое распространение этих генов означает, что вирусы с древнейших времен составляли единый «вирусный мир» и обменивались между собой генами, если одновременно заражали одного хозяина.
Благодаря вирусам можно обойти еще одно сложное место на пути от РНК-геномов к ДНК-геномам. Как мы говорили выше, частота мутаций складывается из двух факторов: ошибки при копировании генома и повреждения геномных молекул между копированиями. Переход от РНК к ДНК снижает уровень повреждений между копированиями, но частота ошибок копирования в момент перехода должна возрасти! При смене типа геномного материала нужны перестройки фермента-полимеразы, который отвечает за копирование. Старая, хорошо отработанная и достаточно точная полимераза при этом неизбежно сменяется на «сырую» и недоработанную. Позже естественный отбор доведет точность новой полимеразы до совершенства, но непосредственно в момент смены РНК на ДНК отбор будет поддерживать старый геном с точной полимеразой. Закрепление замены урацила на тимин еще проблематичнее. Сам по себе тимин ничуть не лучше урацила. Он позволяет находить и исправлять дезаминирование цитозина в геноме, но для этого нужно еще несколько ферментов. Тимин в ДНК выгоднее, чем урацил, когда уже есть система обнаружения урацила в ДНК и замены его на цитозин. Но по отдельности тимидилат-синтаза бесполезна, а система замены урацила вредна, и непонятно, какой из этих ферментов мог возникнуть первым.
Патрик Фортер (Forterre, 2005; Forterre, Prangishvili, 2009) разрешает эту проблему. По его гипотезе эксперименты с новыми полимеразами велись вирусами, а первой выгодой от смены типа генома было ускользание от защитных систем хозяина. Большинство клеток и в наше время используют разные ферментативные системы, опознающие и уничтожающие вирусные ДНК и РНК. «Гонка вооружений» между вирусами и их доклеточными хозяевами могла вызвать очень быструю эволюцию геномных материалов и полимераз для их копирования. И сегодня у вирусов встречаются разнообразные геномные нуклеиновые кислоты, например ДНК с урацилом у бактериофагов PBS1 и PBS2 (Forterre, 2002). Среди вирусов известны ДНК с дополнительными модификациями нуклеотидов: гидроксиметилцитозин у бактериофага T4, гидроксиметилурацил у бактериофага SP01 и 2-аминоаденин у цианофага S-2L (Poole, Logan, 2005). Все эти странные нуклеотиды помогают вирусной ДНК избежать расщепления ферментами хозяина.
Если замена рибозы на дезоксирибозу когда-то позволила вирусу в 10 раз эффективнее заражать жертв ценой 5-кратного роста числа мутаций, то это было выгодное решение. Кроме того, малый размер вирусных геномов смягчает требования к точности копирования. А необходимость долгого автономного существования вирусной частицы без возможности исправить повреждения и без УФ-защиты минералов ужесточает отбор на устойчивость вирусного генома по сравнению с геномом протоклеток. Лишь после отработки в вирусах новые полимеразы были подхвачены их хозяевами (рис. 14.2).
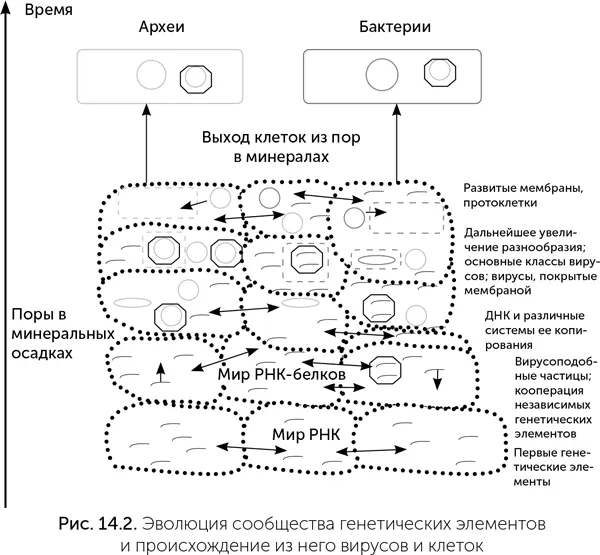
Происхождение систем репликации ДНК
Клеточная ДНК существует в двухцепочечной форме, причем цепи направлены навстречу друг другу. Молекула ДНК-полимеразы, строящая новую цепочку по шаблону старой, всегда двигается в одном направлении – от 3` к 5` концу. Поэтому нельзя просто взять две молекулы ДНК-полимеразы и начать ими синтез двух новых цепей из одной точки двух старых цепей – молекулы ДНК-полимеразы будут двигаться в разные стороны, и большая часть генома в процессе копирования окажется в уязвимой одноцепочечной форме. Чтобы обойти эту сложность, копирование ДНК в клетках идет при помощи специальной молекулярной машины, которая называется «репликативная вилка» и состоит из более чем 20 видов белков. В этом комплексе работа нескольких молекул ДНК-полимеразы согласована так, чтобы не было длинных одноцепочечных участков ДНК.
Читать дальшеИнтервал:
Закладка:







