Сергей Титов - Естествознание. Базовый уровень. 10 класс
- Название:Естествознание. Базовый уровень. 10 класс
- Автор:
- Жанр:
- Издательство:Array Литагент «Дрофа»
- Год:2013
- Город:Москва
- ISBN:978-5-358-13589-5
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Сергей Титов - Естествознание. Базовый уровень. 10 класс краткое содержание
Учебник объединяет сведения об основных законах и закономерностях, наиболее важных открытиях и достижениях в области химии, физики, астрономии, что формирует у учащихся представление о природе как целостной системе, а также о взаимосвязи человека, природы и общества.
Современное оформление, многоуровневые вопросы и задания, дополнительная информация и возможность параллельной работы с электронным приложением способствуют эффективному усвоению учебного материала.
Учебник адресован учащимся 10 класса.
Естествознание. Базовый уровень. 10 класс - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Электролиз растворов солей используют в электрохимии для получения слоя металла на поверхности какого-либо предмета (серебрение, золочение, хромирование). Эту технологию называют гальванопластикой (рис. 136). С помощью гальванопластики можно получить точные металлические копии предметов. Если после электролиза снять с формы отложенный на ней слой металла, он будет повторять её очертания.
Соли широко используют в различных областях промышленности и хозяйства (рис. 137). Многие из них незаменимы в качестве минеральных удобрений: соли азотной кислоты (селитры), соли фосфорной кислоты (фосфатные удобрения).

Рис. 136. Чайнокофейный сервиз мануфактуры Кристофля (1875) – одно из первых применений гальванопластического серебрения и золочения
В строительстве и медицине широко используют гипс – сульфат кальция, главным достоинством которого является способность быстро застывать после смешивания с водой, образуя прочное соединение. Другие соли серной кислоты, например железный и медный купоросы, находят своё применение в производстве красителей, фунгицидов, в медицине и строительстве. Главной составной частью известняка, мела и мрамора является соль угольной кислоты и кальция – карбонат кальция (CaCO 3). Очищенный от посторонних примесей, карбонат кальция широко используется в строительстве, в бумажной и пищевой промышленности, при производстве красок, пластмасс, продукции бытовой химии.
1. Какие вещества относят к солям?
2. Что происходит в процессе электролиза?
3. Расскажите, где в быту используют карбонат кальция.
1. Подберите эпиграф к данному параграфу.
2. Приведите примеры солей, использующихся в промышленности и сельском хозяйстве.
3. Вспомните из курса географии, к какому типу пород относится известняк.

Рис. 137. Многообразие солей (А: синяя – медный купорос, красная – дихромат калия, жёлтая – жёлтая кровяная соль, тёмно-фиолетовая – перманганат калия, белая – хлорид натрия, зелёная – нитрат никеля (II)) и их применение (Б – Ж)
§ 54 Строение и свойства органических веществ
Органическими веществами (за тем небольшим исключением, о котором говорилось выше) являются химические соединения, содержащие в своей молекуле углерод. Кроме него, в состав органических соединений почти всегда входит водород, часто кислород, азот, сера и фосфор, а иногда и многие другие элементы, включая различные металлы. Органические вещества входят в состав всех живых организмов и постоянно в них образуются. Раньше считали, что образование этих соединений вообще невозможно без участия живых организмов, отсюда и произошло их название. Действительно, в неживой природе эти вещества образуются редко и в небольших количествах, поэтому их либо извлекают из организмов, либо получают путём сложного химического синтеза.
Для того чтобы правильно представлять себе формулы органических соединений, следует иметь в виду, что атом углерода в них всегда четырёхвалентен, водород – одновалентен, кислород имеет валентность два, азот – три, а фосфор – пять. Впервые теорию строения органических веществ предложил в 1861 г. российский химик Александр Михайлович Бутлеров(1828–1886). В то время ещё ничего не было известно о строении атома и электронных оболочках, но на основании экспериментальных данных немецким химиком Фридрихом Кекуле(1829–1896) была высказана мысль о том, что атом каждого элемента обладает некоторым числом «единиц сродства» с другими атомами. Ф. Кекуле удалось установить валентности серы, углерода и водорода.
На основе этих идей А. М. Бутлеров разработал принципы построения графических формул химических веществ. Для этого требуется знать валентность каждого элемента, которую изображают на рисунке в виде соответствующего числа чёрточек. Пользуясь этим правилом, легко установить, возможно или невозможно существование вещества с определённой формулой. Так, существует соединение, называемое метаном и имеющее формулу СН 4. Соединение с формулой СН 5невозможно, так как для пятого водорода у углерода уже не найдётся свободной валентности.
Рассмотрим сначала принципы строения наиболее просто устроенных органических соединений. Их называют углеводородами, так как в их состав входят только атомы углерода и водорода (рис. 138). Самым простым из них является упомянутый метан, в котором есть всего один атом углерода. Прибавим к нему ещё один такой же атом и посмотрим, как будет выглядеть молекула вещества, называемого этаном. У каждого атома углерода одна валентность занята его собратом – другим углеродным атомом. Теперь надо заполнить водородом оставшиеся валентности. У каждого атома осталась по три свободных валентных связи, к которым и присоединим по одному атому водорода. Получилось вещество, имеющее формулу С 2Н 6. Прибавим к нему ещё один атом углерода.
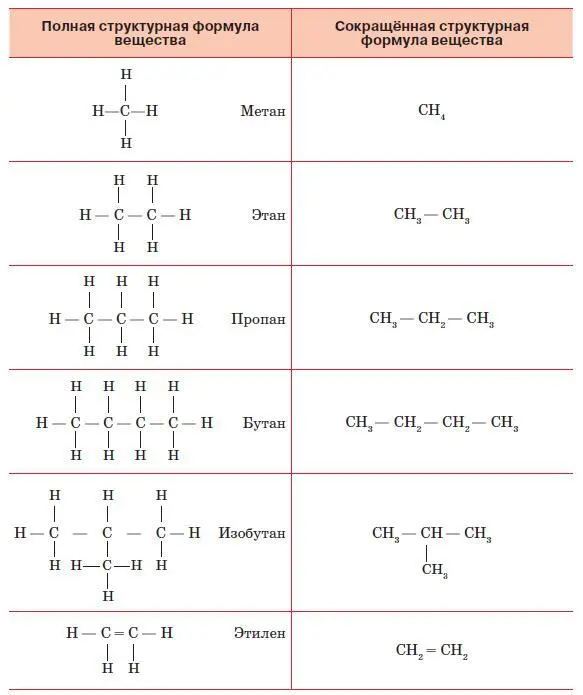
Рис. 138. Полные и сокращённые структурные формулы органических соединений
Теперь мы видим, что у среднего атома осталось только две свободных валентности. К ним мы присоединим по атому водорода. А к крайним углеродным атомам добавим, как и прежде, по три атома водорода. Получим пропан – соединение с формулой С 3Н 8. Такую цепочку можно продолжать, получая всё новые и новые углеводороды.
Но углеродные атомы необязательно должны располагаться в молекуле в линейном порядке. Допустим, что мы хотим добавить к пропану ещё один углеродный атом. Оказывается, это можно сделать двумя способами: присоединить его либо к крайнему, либо к среднему атому углерода пропана. В первом случае мы получим бутан с формулой С 4Н 10. Во втором случае общая, так называемая эмпирическая, формула будет такой же, но изображение на рисунке, называемое структурной формулой, будет выглядеть иначе. И название вещества будет несколько иное: не бутан, а изобутан.
Вещества, имеющие одну и ту же эмпирическую, но разные структурные формулы, называют изомерами, а способность вещества существовать в виде различных изомеров – изомерией. Мы, например, употребляем в пищу различные вещества, имеющие одну и ту же формулу С 6Н 12О 6, но структурные формулы они имеют различные и носят разные названия: глюкоза, фруктоза или галактоза.
Читать дальшеИнтервал:
Закладка:










