Николай Бетенеков - Физико-химические основы синтеза и применения тонкослойных неорганических сорбентов
- Название:Физико-химические основы синтеза и применения тонкослойных неорганических сорбентов
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2019
- ISBN:978-5-532-10887-5
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Бетенеков - Физико-химические основы синтеза и применения тонкослойных неорганических сорбентов краткое содержание
Физико-химические основы синтеза и применения тонкослойных неорганических сорбентов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Таким образом, изучение и учет физико-химического поведения микрокомпонентов в сложных системах является не только чисто исследовательской проблемой, но и затрагивает технологические разработки, а для решения экологических задач может стать определяющим.
Под термином "состояние" в радиохимии подразумевается совокупность всех форм, образованных радионуклидом в водном растворе:
а) простые акваионы – M (H 2O) N z+;
б) ионные пары или внешнесферные комплексы;
в) комплексные ионы, образованные центральным ионом ( М z+ ) и лигандами ( L n- ), причем лиганды могут быть одинаковой или различной химической природы – {M(H 2O) N-iL i} z-ni ;
г) моноядерные продукты гидролиза {M(H 2O) N-i(OH) i} z-i ;
д) полиядерные гидроксокомплексы – {M j(H 2O) j(N-i)(OH) i} jz-i ;
е) гетерополиядерные гидроксокомплексы;
ж) истинные радиоколлоиды;
з) псевдорадиоколлоиды.
Знание форм состояния радионуклидов чрезвычайно важно, так как они определяют поведение радионуклида в любых технологических операциях (сокристаллизация, соосаждение, сорбция, ионный обмен, экстракция, электролиз и т.п.). Поэтому представляют интерес расчетные методы, позволяющие на основании справочных данных получить предварительную оценку концентрации (или доли) каждой из возможных форм состояния радионуклида в растворе конкретного состава.
1.2. Ионо-дисперсное состояние микрокомпонентов в растворах. Комплексные соединения
Комплексные (координационные) соединения. Устойчивость координационных соединений. Внутрикомплексные (хелатные) соединения. Лиганды. Дентатность лиганда. Монодентатные и полидентатные лиганды. Устойчивость внутрикомплексых соединений. Размер хелатного цикла. Хелатный эффект.
К ионно-дисперсным формам относятся простые акваионы, моноядерные, полиядерные и гетрополиядерные комплексы.
Описание ионодисперсных форм обычно осуществляют с позиций образования комплексных соединений.
Комплексные соединения или, другими словами, координационные соединения – это частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому ''комплексообразователем'' (центральным атомом), нейтральных молекул или других ионов, называемых лигандами. Для комплексного соединения характерно то, что он сохраняется как самостоятельная единица даже в растворе, хотя может происходить и частичная диссоциация. Комплекс может быть нейтральной частицей или иметь положительный или отрицательный заряд в зависимости от заряда центрального атома и координированных групп – лигандов. В растворе простые ионы не существуют, они образуют с молекулами растворителя сольватные (для водных растворов – акво-) комплексы. Молекулы растворителя более или менее прочно связаны с ионами, молекулы первой сольватной оболочки расположены вокруг иона в определенном порядке. Количество и расположение молекул растворителя вокруг центрального атома определяется объемом иона, плотностью заряда на нем и пространственными условиями. Следовательно, реакцию образования комплексов в растворе можно рассматривать как реакцию обмена молекул растворителя на молекулы лигандов:
M(H 20) n+L→ М(Н 2О) п–1L + H 20, (1.1)
М – центральный ион, L – лиганд (органический или неорганический ион или нейтральная молекула), заряды для простоты опущены.
В процессе комплексообразования молекулы растворителя, окружающие центральный ион могут последовательно замещаться ионами или молекулами лиганда, что в итоге приводит к образованию комплекса ML n , где n – число лигандов в комплексе. Это число равно координационному числу, если лиганды образуют с центральным ионом только одну связь. Координационное число зависит от природы лиганда, поэтому к приписыванию данному центральному иону одного определенного координационного числа следует относиться с осторожностью. Классический подход к определению структуры координационных соединений заключался в том, чтобы установить структуру неизвестного соединения на основе структур известных изомеров. Структуры плоского квадрата, тетраэдра и октаэдра (рис. 1.2.), приписанные соединениям, были подтверждены физико-химическими методами. Хотя наиболее часто встречаются координационные числа 6 или 4, известны соединения, в которых центральный ион имеет координационное число вплоть до 10 – 12.
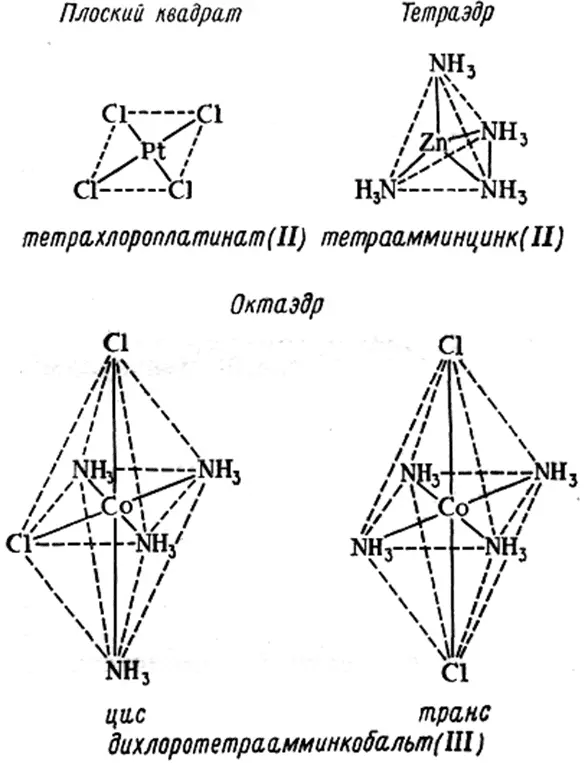
Рис. 1.2. Образование комплексов различной структуры [1] .
В общем случае образование комплексного соединения можно выразить следующим уравнением:
mM + nL↔M mL, (1.2)
тогда термодинамическая константа комплексообразования:
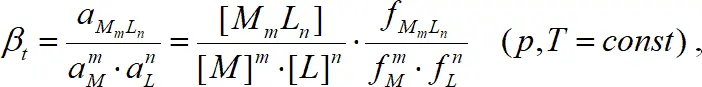 (1.3)
(1.3)
где a M = f[ M ] – активность, f – коэффициент активности, [ ] – символ концентрации. Согласно теории Дебая-Хюккеля, коэффициенты активности в разбавленных растворах в первом приближении определяются только ионной силой раствора и могут быть рассчитаны по уравнению Дэвиса [2].
При постоянной ионной силе J = const концентрационная константа β отличается от термодинамической константы β tпри J = 0 на постоянную величину, поэтому
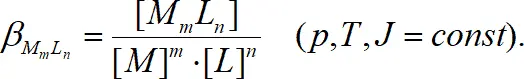 (1.4)
(1.4)
Если в структуре комплекса существует только один центральный атом, то он называется моноядерным, если m ≠ 1, то полиядерным. Хотя полиядерные комплексы встречаются также часто, как и моноядерные, в большинстве случаев их образованием пренебрегают, особенно при низких концентрациях.
Комплексы обычно образуются ступенчато, процесс характеризуется ступенчатыми константами комплексообразования K i:
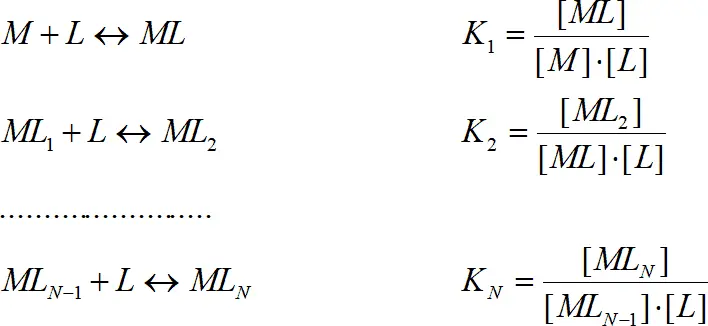 (1.5)
(1.5)
Проведя подстановки:
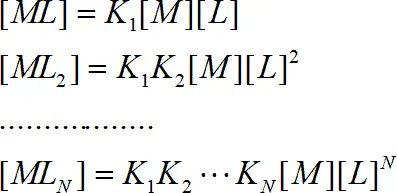
получаем
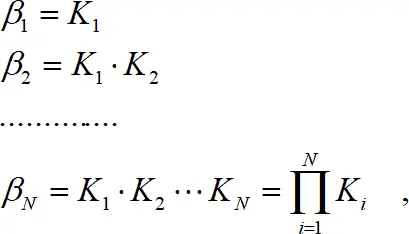 (1.6)
(1.6)
где β N – общая константа образования (устойчивости). В данном выражении N – число присоединенных лигандов, а не координационное число. Если рассматривать обратный процесс, то получаем реакцию диссоциации, которая характеризуется константой диссоциации или нестойкости k :
Читать дальшеИнтервал:
Закладка: