Николай Бетенеков - Физико-химические основы синтеза и применения тонкослойных неорганических сорбентов
- Название:Физико-химические основы синтеза и применения тонкослойных неорганических сорбентов
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2019
- ISBN:978-5-532-10887-5
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Бетенеков - Физико-химические основы синтеза и применения тонкослойных неорганических сорбентов краткое содержание
Физико-химические основы синтеза и применения тонкослойных неорганических сорбентов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
 (1.7)
(1.7)
Константы нестойкости ступенчатые – обратные величины ступенчатым константам устойчивости. Общая константа нестойкости
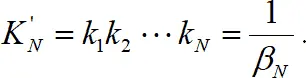 (1.8)
(1.8)
Для определения констант и описания форм состояния ионов в растворе имеют большое значение соотношения между константами и аналитически измеряемыми величинами. Общая концентрация металла в растворе в виде свободного иона и комплексных частиц определяется уравнением:
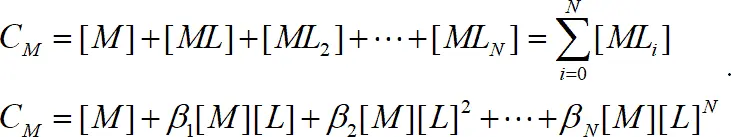 (1.9)
(1.9)
Введя 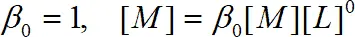 , получаем
, получаем
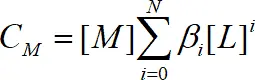 , N – максимальное число лигандов в комплексе.
, N – максимальное число лигандов в комплексе.
Общую концентрацию лиганда можно определить:
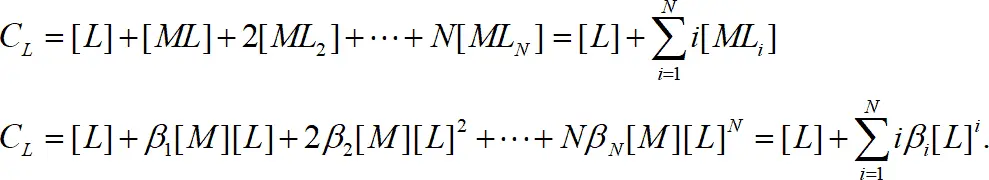 (1.10)
(1.10)
Для определения степени закомплексованности Нильс Бьеррум предложил использовать среднее координационное или лигандное число, которое при заданных концентрации лиганда и константах устойчивости комплекса характеризует глубину комплексообразования. Среднее лигандное число и дает число лигандов, связанных с одним ионом металла – комплексообразователя во всех типах комплексов, т.е
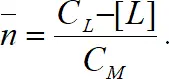
Подставив соответствующие выражения, получаем:
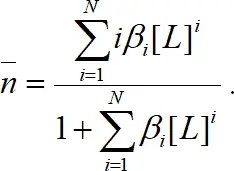 (1.11)
(1.11)
При заданных β iсреднее лигандное число зависит только от концентрации лиганда и не зависит от концентрации металла в растворе (рис. 1.3). Это утверждение справедливо только для случая образования моноядерных комплексов. Если C L>>C M, то [L] ≈ C L. Когда C L<10C M, то при расчете нельзя пренебрегать связанным в комплекс лигандом.
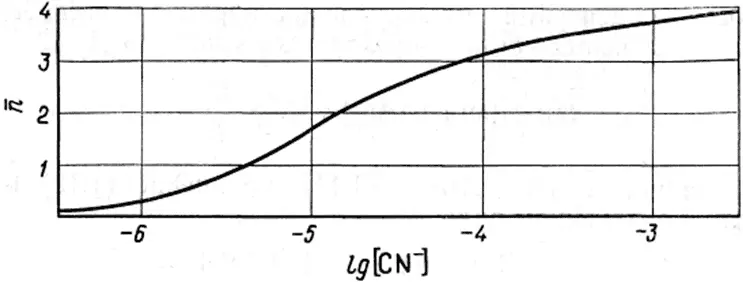
Рис. 1.3. Изменение среднего лигандного числа в зависимости от концентрации лиганда для цианидных комплексов кадмия [1].
Еще одна величина, которая нашла широкое применение, – это мольная доля i– комплекса в растворе α i.
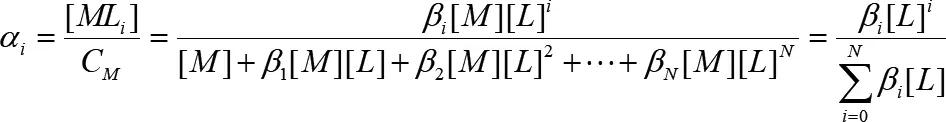 (1.12)
(1.12)
Из определения следует 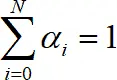 . α i зависят только от концентрации лиганда и не зависят от концентрации металла в растворе (рис. 1.4).
. α i зависят только от концентрации лиганда и не зависят от концентрации металла в растворе (рис. 1.4).
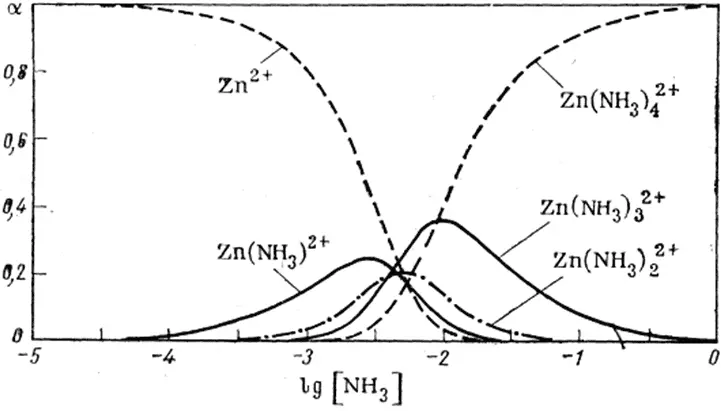
Рис. 1.4. Доля аммиачных комплексов цинка, как функция концентрации свободного аммиака [2].
При такой концентрации лиганда, при которой один из комплексов присутствует в максимальных количествах (α i=max), n̄ соответствует числу лигандов, связанных в этом комплексе. Абсциссы точек пересечения кривых мольных долей, т.е. точек, в которых концентрации двух последовательных комплексов одинаковы, равны отрицательным логарифмам ступенчатых констант устойчивости:
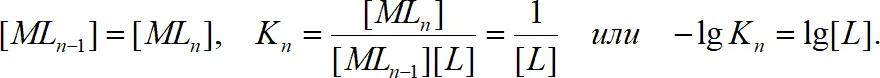 (1.13)
(1.13)
Если ион металла образует комплексы с несколькими видами лигандов, то распределение по формам можно рассчитать аналогично:
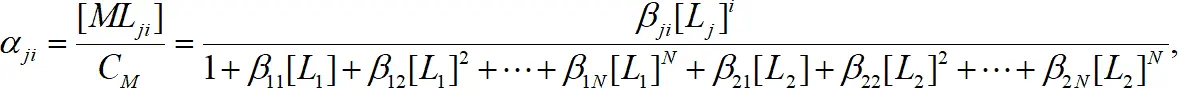
или в общем случае
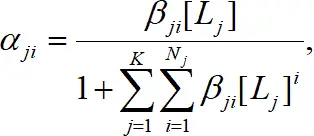 (1.14)
(1.14)
где К – число различных видов лигандов, участвующих в комплексообразовании (рис. 1.5).
Равновесия образования полиядерных комплексов рассмотрим в части, посвященной процессам гидролиза.
Приведенные уравнения и константы характеризуют процесс образования внутрисферного комплекса в результате проявления сил близкодействия, что приводит к молекулярному контакту между ионом-комплексообразователем и лигандами. Если лиганды способны образовывать вторую и более удаленные сферы, то говорят об образовании внешнесферных комплексов. Возможность образования внутрисферного комплекса определяется напряженностью поля и особностью к поляризации, следовательно, зарядом и радиусом иона, т.е.
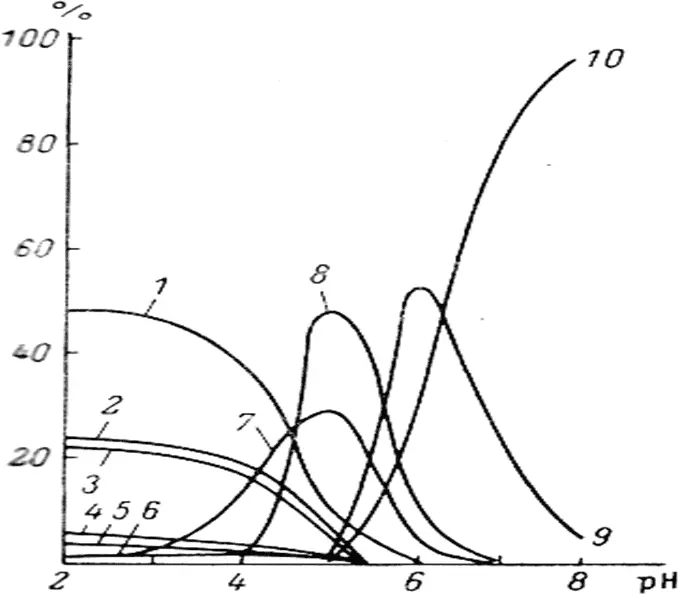
Рис. 1.5. Состояние урана (VI) в морской воде в зависимости от рН: 1 – UO 2F +; 2 – UO 2SO 4; 3 – UO 2 2+; 4 – UO 2Cl +; 5 – UO 2(SO 4) 2 2-; 6 – UO 2F 3 -; 7 – UO 2OH +; 8 – UO 2(OH) 2; 9 – UO 2(CO 3) 2 2-; 10 – UO 2(CO) 3 4-[13].
Координирующая способность растет с увеличением ионного потенциала центрального иона. Образование внешнесферного комплекса происходит по типу образования ионных пар. Например, аномальная величина ионного потенциала Li обуславливает его наибольшую поляризующую способность и наименьшую поляризуемость среди всех щелочных металлов. В поле, которое создает Li +происходит процесс структурирования воды: молекулы воды, которые представляют собой диполи, ориентируются в поле Li +, образуя внутреннюю и внешние сферы (рис. 1.6).
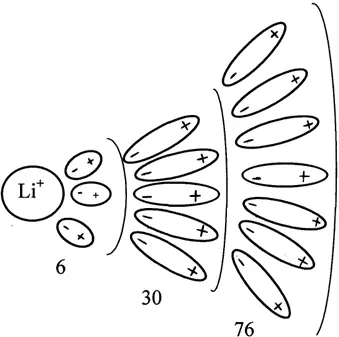
Рис. 1.6. Процесс структурирования воды в поле Li +.
В водном растворе в результате этого литий имеет наибольший радиус, что объясняет его меньшую подвижность по сравнению с подвижностью ионов калия и натрия. По величине гидратированного иона лития (10 Å) можно вычислить, что в первой сфере он имеет – 6, во второй – 30, а в третьей – 76 молекул воды, что естественно, оказывает определяющее влияние на его химические свойства и физико-химическое поведение в водных растворах.
Внешнесферные комплексы могут быть идентифицированы по изменению некоторых характеристик, в частности, спектральных. Для лабильных систем (когда лиганды, входящие в состав внутренней и внешней сфер, могут легко меняться местами) трудно провести различие между внешнесферными и внутрисферными комплексами. Возможно, превращение внешнесферного комплекса во внутрисферный происходит в результате химической реакции
Читать дальшеИнтервал:
Закладка: